
| A. | 氯化钠会沉降出来 | B. | 氯化钠不会分离出来 | ||
| C. | 氯化钠可能变成其他物质 | D. | 无法确定 |
 优等生题库系列答案
优等生题库系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 设计这一步骤的目的 |
| 1.将配制的氢氧化钠溶液加热 | |
| 2.在加热后的溶液中滴入酚酞,并在上方滴一些植物油 |
| 实验方法 | 可能观察到的现象和结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |
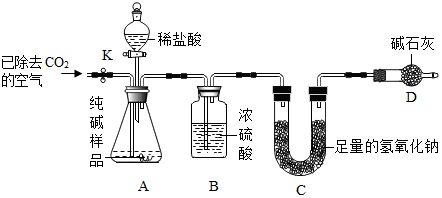
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
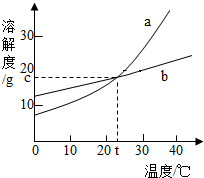 如图是a、b两种固体物质的溶解度曲线.
如图是a、b两种固体物质的溶解度曲线.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com