
 化学活动课上同学们对金属的性质及合金的成份进行了探究,请你参与.
化学活动课上同学们对金属的性质及合金的成份进行了探究,请你参与.| 药品/序号 | A | B | C | D |
| 金属 | 铜粉 | 锌粉 | 锌粉 | 镁粉 |
| 稀硫酸 | 9.8%硫酸 | 19.6%硫酸 | 9.8%硫酸 | 9.8%硫酸 |
| 实验操作 | 实验现象 | 结论和化学方程式 |
| 向M中加入ag铁粉、搅拌 | 化学方程式:Fe+CuSO4=FeSO4+Cu Fe+H2SO4═FeSO4+H2↑ M中的溶质:CuSO4、H2SO4 | |
| 过滤,把所得固体洗涤、干燥,称其质量也为ag,并向此固体中加入稀硫酸 | 无明显现象 |
分析 根据金属的性质进行分析解答,在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来;某些金属能与氧气反应生成金属氧化物,根据反应前后的质量确定金属的类别,据此解答.
解答 解:(1)①锌能与硫酸反应生成硫酸锌和氢气,镁能与硫酸反应生成硫酸镁和氢气,故填:Zn+H2SO4═ZnSO4+H2↑或Mg+H2SO4═MgSO4+H2↑;
②要比较金属的活动性顺序,可以依据金属能否与酸反应以及与酸反应的剧烈程度,需要控制金属的质量、酸的类别、酸的质量分数以及金属与酸的接触面积,故选择ACD三组实验即可,故填:ACD;
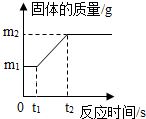
(2)①取该合金m1g,在足量氧气中反应,生成固体质量为m2g,则是生成的氧化物的则是,故根据图示可以看出,(m1-m2)g表示的是参加反应的氧气的质量,故填:参加反应的氧气的质量;
②加入铁粉以后得到的固体中加入稀硫酸,没有现象,说明该金属不能与稀硫酸反应,故是铜,也就是说将铁粉加入M中,铁能与其中含有的硫酸铜反应生成硫酸亚铁和铜,故会观察到有红色固体析出;
Fe+CuSO4=FeSO4+Cu
56 64
Fe+H2SO4═FeSO4+H2↑
56
根据该反应的化学方程式可以看出,若只是铁与硫酸铜反应,反应后固体质量增加,故不可能是铁只与硫酸铜反应,必然有一部分铁会与硫酸反应,故M中的溶质含有硫酸和硫酸铜,故填:
| 实验操作 | 实验现象 | 结论和化学方程式 |
| 向M中加入ag铁粉、搅拌 | 有红色固体析出,有气泡产生 | 化学方程式:Fe+CuSO4=FeSO4+Cu Fe+H2SO4═FeSO4+H2↑ M中的溶质:CuSO4、H2SO4 |
| 过滤,把所得固体洗涤、干燥,称其质量也为ag,并向此固体中加入稀硫酸 | 无明显现象 |
点评 本题考查的是金属性质的实验探究,完成此题,可以依据已有的金属的性质以及物质间反应的实验现象、化学方程式的计算进行.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 冰雪融化、光合作用 | B. | 发光放热、食物易腐败 | ||
| C. | 电解水、氢气有可燃性 | D. | 汽油挥发、钢铁易生诱 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 实验室利用下列装置可以制取某些气体,请据图回答问题:
实验室利用下列装置可以制取某些气体,请据图回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 如图是元素周期表中提供的钛元素的相关信息,对图中信息理解错误的是( )
如图是元素周期表中提供的钛元素的相关信息,对图中信息理解错误的是( )| A. | 该元素的质子数为22 | B. | 该元素的相对原子质量为22 | ||
| C. | 该元素在化学变化中容易失去电子 | D. | 该元素属于金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com