
 ,计算t℃时氯化钠饱和溶液的溶质的质量分数;
,计算t℃时氯化钠饱和溶液的溶质的质量分数; ,计算5g硫酸铜溶于95g水中所得溶液的溶质质量分数.
,计算5g硫酸铜溶于95g水中所得溶液的溶质质量分数.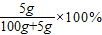 ≈4.7%<5%;
≈4.7%<5%;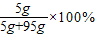 =5%;
=5%; ,利用该算法可以方便地解决饱和溶液的溶质质量分数类问题.
,利用该算法可以方便地解决饱和溶液的溶质质量分数类问题. 

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
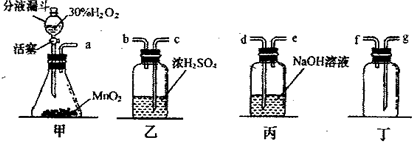
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com