
分析 (1)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.
(2)根据酸具有相似化学性质的原因,进行分析解答.
解答 解:(1)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式4HNO3$\frac{\underline{\;光照\;}}{\;}$4NO2↑+2H2O+X↑,反应前氢、氮、氧原子个数分别为4、4、12,反应后的生成物中氢、氮、氧原子个数分别为4、4、10、根据反应前后原子种类、数目不变,则每个X分子由2个氧原子构成,则物质X的化学式为O2.
(2)硝酸具有酸的一些共性,是因为它在水溶液中能解离出氢离子,其离子符号为:H+.
故答案为:(1)O2;(2)H+.
点评 本题难度不大,掌握酸的化学性质、质量守恒定律并能灵活运用是正确解答本题的关键.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 等质量的CO和CO2,CO和CO2中氧元素的质量比为14:11 | |
| B. | 等质量的Al和Mg分别与足量稀硫酸充分反应,生成H2的质量相等 | |
| C. | 等质量的NaHCO3和MgCO3分别与足量稀盐酸反应,生成CO2的质量相等 | |
| D. | 等质量的质量分数均为4%的氢氧化钠溶液和稀盐酸充分反应后,所得溶液显中性 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
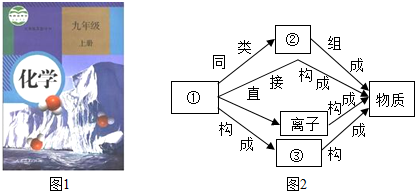
 进行描述,则相应的语言应是两个氢原子和一个氧原子构成一个水分子,许多的水分子构成水.
进行描述,则相应的语言应是两个氢原子和一个氧原子构成一个水分子,许多的水分子构成水.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
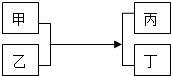 甲、乙、丙、丁四种物质在一定条件下能发生如下转化.
甲、乙、丙、丁四种物质在一定条件下能发生如下转化.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 除去氮气中混有的氧气 | 将气体通过灼热的铜网 |
| B | 区分硬水和软水 | 过滤 |
| C | 除去二氧化碳中少量的一氧化碳 | 点燃 |
| D | 验证二氧化碳是否集满 | 将带火星的木条伸入集气瓶中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com