
| 溶质质量分数/% | 纯水 | 1 | 4 | 10 | 16 | 24 | 32 | 36 | 44 | 49 | 60 | 98 |
| 密度/g?mL-1 | 1.00 | 1.01 | 1.02 | 1.07 | 1.11 | 1.17 | 1.24 | 1.27 | 1.34 | 1.39 | 1.50 | 1.84 |
 =50g,需要水的质量=200-50=150g,
=50g,需要水的质量=200-50=150g, ≈27mL
≈27mL

科目:初中化学 来源: 题型:
查看答案和解析>>
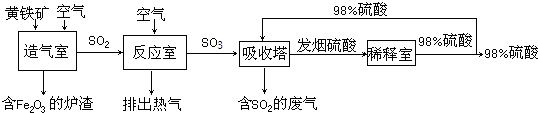
科目:初中化学 来源: 题型:
 实验室中,用98%的浓硫酸稀释成100g 20%的稀硫酸.根据如图所示的市售浓硫酸的标签,回答下列问题:
实验室中,用98%的浓硫酸稀释成100g 20%的稀硫酸.根据如图所示的市售浓硫酸的标签,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源:2011-2012年江苏省扬州市宝应县城北初中九年级(下)化学假期作业(6月份)(解析版) 题型:解答题

查看答案和解析>>
科目:初中化学 来源:2012年江苏省扬州市宝应县城北中学中考化学冲刺试卷(4)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com