
小明用下图所示装置测定空气中氧气的含量.
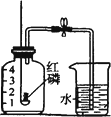
(1)实验时,取下橡胶塞,点燃红磷后迅速伸入集气瓶中并旋紧橡胶塞,这时看到的现象是________,该反应的化学方程式为________;
(2)小明又设计了如下图所示的改进装置,其优点是________(只需写一点).从理论上分析,玻璃管内液面最终将上升至________处(填“1”、“2”、“3”、“4”),但实测结果液面往往偏低,其原因可能是________(只需写一条);

(3)他在一本参考书上发现,镁居然能在氮气中燃烧.于是他用镁代替红磷做起了这个实验,实验完毕,你认为进入集气瓶中水的体积________(填大于、小于或等于)总容积的1/5
科目:初中化学 来源: 题型:
 29、小明设计了如下图所示的实验装置来证明氧化铜能加快过氧化氢溶液的分解,并与相同条件下MnO2的催化效果做比较,实验时间均以生成30mL气体为准(即比较反应速率).用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:
29、小明设计了如下图所示的实验装置来证明氧化铜能加快过氧化氢溶液的分解,并与相同条件下MnO2的催化效果做比较,实验时间均以生成30mL气体为准(即比较反应速率).用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:| 实验序号 | 过氧化氢溶液体积 | 催化剂 | 待测数据 |
| ① | 15mL | 无 | |
| ② | 15mL | CuO(0.5g) | |
| ③ | 15mL | MnO2(0.5g) |
| 实验步骤和现象 | 设计这一步骤的目的 |
| (1)取15mL过氧化氢溶液,加入0.5g CuO后,产生O2的速率比未加入时快得多 | CuO能加快过氧化氢溶液的分解 |
| (2)把上述混合物,过滤所得固体晾干后称重 | 氧化铜的质量不变 |
| (3)将所得固体重新与过氧化氢溶液混合,观察是否依旧能加快过氧化氢溶液的分解 | 氧化铜的化学性质不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:
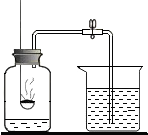 (2013?芜湖县模拟)小明为了测定空气的成分,按下图所示装置做实验:
(2013?芜湖县模拟)小明为了测定空气的成分,按下图所示装置做实验:| 1 |
| 5 |
| 1 |
| 5 |
| 点燃 |
| 点燃 |
查看答案和解析>>
科目:初中化学 来源:2012届江苏省江阴初级中学九年级5月中考模拟化学试卷(带解析) 题型:探究题
(9分)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
I、实验方案
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,测得的pH逐渐变小直到pH小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
⑴反应后,所得溶液显 性(填“酸”、“碱”或“中”)
⑵用pH试纸测定NaOH溶液pH时,正确的操作是:
。
⑶简述强调“测得的pH小于7”的理由:
______________________________________________________________________________。
方案二:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
该组同学将不同浓度的盐酸和NaOH溶液各10 克混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65﹪ | 2.00﹪ | 3.5 |
| 2 | 3.65﹪ | 4.00﹪ | x |
| 3 | 7.30﹪ | 8.00﹪ | 14 |


| 称 量 项 目 | 称 量 时间 | 质量(g) |
| 试样 | | 10.00 |
| 装置+稀硫酸质量 | | 241.20 |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 249.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 247.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 247.00 |
查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省九年级5月中考模拟化学试卷(解析版) 题型:探究题
(9分)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
I、实验方案
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,测得的pH逐渐变小直到pH小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
⑴反应后,所得溶液显 性(填“酸”、“碱”或“中”)
⑵用pH试纸测定NaOH溶液pH时,正确的操作是:
。
⑶简述强调“测得的pH小于7”的理由:
______________________________________________________________________________。
方案二:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
该组同学将不同浓度的盐酸和NaOH溶液各10 克混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
|
编号 |
盐酸 |
NaOH溶液 |
△t/℃ |
|
1 |
3.65﹪ |
2.00﹪ |
3.5 |
|
2 |
3.65﹪ |
4.00﹪ |
x |
|
3 |
7.30﹪ |
8.00﹪ |
14 |
⑷表中x = 。
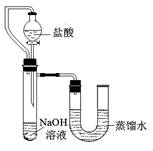
⑸某同学在没使用温度计的情况下,通过下图所示装置完成了实验。则该同学根据实验现象:
,判断NaOH溶液与稀盐酸发生了中和反应。
II、实验中的意外情况
在实验过程中,他们发现盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:① 可能是NaOH;② 可能是Na2CO3; ③ 可能是NaOH和Na2CO3。
⑹小明同学取白色粉末少许,溶于水后,先向溶液中加入足量的 溶液,看到白色沉淀产生,然后向上层清液中加入酚酞试液,看到溶液呈红色,验证了猜想③是正确的。
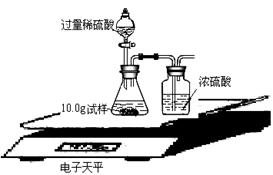
⑺为了进一步研究,三位同学取了10.0g上述样品,利用电子天平共同做了下图所示的实验。

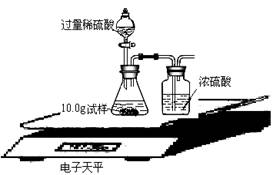
实验数据记录如下:
|
称 量 项 目 |
称 量 时 间 |
质量(g) |
|
试样 |
|
10.00 |
|
装置+稀硫酸质量 |
|
241.20 |
|
装置+稀硫酸质量+试样 |
反应开始后15秒 |
249.20 |
|
装置+稀硫酸质量+试样 |
反应开始后35秒 |
247.00 |
|
装置+稀硫酸质量+试样 |
反应开始后55秒 |
247.00 |
试通过分析表中数据计算上述样品中各成份的质量分数分别是多少?(写出计算过程)。
(8)有同学提出按上述实验所测得试样中Na2CO3质量分数会偏小,该同学的理由是(实验操作均正确): 。
查看答案和解析>>
科目:初中化学 来源: 题型:
 学了炼铁原理后,小明想用此原理测定某一生锈铁粉中氧化铁的
学了炼铁原理后,小明想用此原理测定某一生锈铁粉中氧化铁的![]() 质量分数。于是他取m1 g生锈的铁粉样品,按下图所示装置进行实验,测定该样品中氧化铁的质量分数(铁锈按氧化铁处理)。
质量分数。于是他取m1 g生锈的铁粉样品,按下图所示装置进行实验,测定该样品中氧化铁的质量分数(铁锈按氧化铁处理)。
|
(1)装置A中反应的化学方程式是___________________。
(2)某同学欲通过B装置反应前后的质量变化,测定该样品中氧化铁的质量分数。
B中![]() 的最佳试剂是_____(填序号),实验时B中反应的化学方程式是_____。
的最佳试剂是_____(填序号),实验时B中反应的化学方程式是_____。
① 澄清石灰水 ② 氢氧化钠浓溶液 ③ 稀盐酸 ④ 水
(3)上述实验过程中,CO气体除作为反应物外,还能起到的作用是:① 实验开始时,排尽装置中的空气,防止加热时发生爆炸;② 停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;③______________________。
(4)完全反应后,甲同学称得铁粉的质量为m2 g,同时测得装置B增重m3 g,则铁粉样品中氧化铁的质量分数为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com