
| A. | 该气体一定是碳氢两种元素组成的化合物 | |
| B. | 该气体中一定含有碳、氢、氧三种元素 | |
| C. | 该气体中一定含有碳、氢二种元素,可能含有氧元素 | |
| D. | 该气体一定是氧化物 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
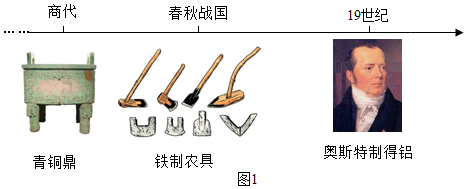

查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| 物质 | M | N | Q | P | |
| 反应前质量(g) | 18 | 1 | 2 | 32 | |
| 反应后质量(g) | X | 26 | 2 | 12 | |
| A. | 该变化的基本反应类型是分解反应 | B. | 反应后物质M的质量为l3g | ||
| C. | 反应中N、P的质量比为5:4 | D. | 物质Q必定是该反应的催化剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
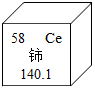 金属是一类重要的物质.
金属是一类重要的物质.查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氯化钠溶液中混有少量的了氯化铜--加入过量的氢氧化钠溶液过滤 | |
| B. | 二氧化碳气体混有少量氯化氢--将气体通过氢氧化钠溶液 | |
| C. | 氯化亚铁溶液中混有少量的氯化铜--加入过量铁粉过滤 | |
| D. | 生石灰中混有少量的石灰石--加入稀盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
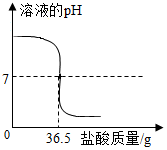 中和反应在工农业生产中应用广泛,现向40g 10%的氢氧化钠溶液中不断滴加盐酸,同时测定溶液pH的变化(曲线如图),
中和反应在工农业生产中应用广泛,现向40g 10%的氢氧化钠溶液中不断滴加盐酸,同时测定溶液pH的变化(曲线如图),查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 图示 |  |  |  | 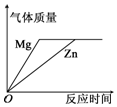 |
| 选项 | A、向pH=10的 Ca(OH)2溶液 中不断加水稀释 | B、向NaOH和Na2CO3混合溶液中逐滴加入稀盐酸 | C、在40℃,将接近饱和的硝酸钾溶液恒温蒸发水分 | D、将足量的金属镁片和锌片分别和等质量的相同质量分数的稀硫酸混合 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com