
化学与生活息息相关。
(1)蒸鸡蛋是一道非常适合考生的补脑食品,鸡蛋中的鸡蛋清主要含有的基本营养素是_________。
(2)碘元素是人体必需的微量元素,缺乏碘元素会引起_____。
(3)炒菜完毕,关闭煤气罐阀门,燃着的煤气熄灭,其灭火的原理是_____________。
(4)洗涤剂可用来洗碗,是因为它对油污具有_____功能。
(5)常温下,铝制品耐腐蚀不易生锈的原因是_____。(用化学方程式表示)
蛋白质 甲状腺肿大(或大脖子病) 隔离可燃物 乳化 4Al+3O2=== 2Al2O3 【解析】(1). 鸡蛋中的鸡蛋清主要含有的基本营养素是蛋白质 ; (2). 缺乏碘元素会引起甲状腺肿大(或大脖子病),少儿缺碘易导致呆小症; (3). 燃烧是可燃物与氧气充分接触发生的发光、放热的剧烈的氧化反应。燃烧需要同时具备的三个条件:物质有可燃性、温度达可燃物的着火点、与氧气充分接触;灭火时只需要破... 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:初中化学 来源:河北省唐山市滦南县2018届九年级下学期模拟考试化学试卷 题型:单选题
下列有关物质分类的说法正确的是( )
A.非金属都是绝缘体
B.有一定熔点的固体都是晶体
C.含有氧元素的化合物都是氧化物
D.含有碳元素的化合物都是有机化合物
B查看答案和解析>>
科目:初中化学 来源:安徽省2017-2018学年九年级下学期4月段考化学试卷 题型:简答题
某化工厂的金属废料主要成分是铜粉还含有铁粉,需回收此废料中的铜.现取废料样品l0.0g,向其中加入足量的稀硫酸完全反应后(反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑)共收集到0.1g 氢气.试求:
(1)废料中铜的质量分数为多少?
(2)现有废料20.0t,共可回收铜的质量为多少?
废料中铜的质量分数为72.0% 20.0t该种废料可回收铜的质量为14.4t 【解析】设10.0g废料样品中铁的质量为 x, Fe+H2SO4=FeSO4+H2↑ 56 2 xg 0.1g 解得,x=2.8g (1)铜的质量分数为:=72.0% (2)共可回收铜的质量=20.0t×72.0%=14.4t 答:废料中铜的质量分数为72.0%,20...查看答案和解析>>
科目:初中化学 来源:安徽省2017-2018学年九年级下学期4月段考化学试卷 题型:单选题
一般情况下,两种活泼性不同的金属在潮湿的环境中接触时,活泼性强的金属首先被腐蚀。为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌的金属是( )
A. 锌板 B. 银板 C. 铜板 D. 锡板
A 【解析】根据金属活动性顺序,五种金属的活动性强弱关系为锌>铁>锡>铜>银,根据分析,为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌的金属是锌板。故选A。查看答案和解析>>
科目:初中化学 来源:福建省2018届初三第二学期期中考试化学试卷 题型:科学探究题
小玲的爸爸是化学教授,她对爸爸的一项研究成果产生了兴趣:CO2与Na在高温高压、催化剂的作用下,可以制得纳米级别的金刚石和一种白色固体。为了探究该白色固体的成分,小玲和同学一起来到爸爸的实验室,请你和她们一起完成如下探究:
【提出问题】白色固体的成分是什么?
【查阅资料】a.碳酸钠(Na2CO3)、氧化钠(Na2O)均为白色固体;b.氧化钠与水常温下反应生成氢氧化钠,Na2O+H2O=== 2NaOH。
【猜想与假设】根据资料,小玲与两位同学提出以下猜想:
甲同学:“白色固体是氧化钠(Na2O)”;
乙同学:“白色固体是碳酸钠(Na2CO3)”;
小玲:“________________________________”。
【实验与结论】①甲同学为验证猜想,取白色固体样品于试管中,加适量水,滴加无色酚酞溶液,通过酚酞溶液变红就判断自己的猜想正确,但遭到其他同学反对,原因是:_______;
②为了验证自己的猜想,小玲设计了以下方案进行验证:
实验步骤 | 实验现象 | 实验结论 |
Ⅰ.取少量白色固体样品于试管中,加入足量水使之溶解,并加入过量的________,观察现象 | 试管中产生白色沉淀 | 白色固体中有碳酸钠 |
Ⅱ.往实验Ⅰ反应后的试管中滴加________,观察现象 | _________ | 白色固体中没有氧化钠 |
③通过上述实验可证明乙同学猜想正确,请写出金属钠与二氧化碳反应的化学方程式________________________。
白色固体是氧化钠和碳酸钠的混合物 碳酸钠溶液也显碱性 氯化钙溶液(或氯化钡溶液等) 无色酚酞溶液(或硫酸铜溶液或氯化铁溶液等) 无明显现象 4Na+3CO2===2Na2CO3+C 【解析】【猜想与假设】根据甲、乙同学的猜想分析解答; 【实验与结论】①根据碳酸钠溶液显碱性解答;②Ⅰ.根据生成碳酸盐的沉淀分析解答;Ⅱ.根据氧化钠与水反应的产物氢氧化钠显碱性分析解答; ③根据钠与二氧...查看答案和解析>>
科目:初中化学 来源:福建省2018届初三第二学期期中考试化学试卷 题型:单选题
分类法是化学研究的重要方法。以下分类不正确的是
A. 合金:生铁、青铜、硬铝 B. 氧化物: 水、二氧化锰、五氧化二磷
C. 碱: 纯碱、生石灰、苛性钠 D. 合成材料:塑料、合成橡胶、合成纤维
C 【解析】A、合金,是由两种或两种以上的金属与非金属经一定方法所合成的具有金属特性的物质,生铁是含碳的铁合金;青铜是铜和锡的合金;硬铝是铝、铜、镁、硅的合金,故A正确;B、氧化物是由两种元素组成,并且有一种元素为氧元素的化合物,所以水、二氧化锰、五氧化二磷均属于氧化物,故B正确;C、碱是指电离时产生的阴离子全部是氢氧根离子的化合物,而碳酸钠是由钠离子与碳酸根离子构成的化合物,属于盐,故C错...查看答案和解析>>
科目:初中化学 来源:江苏省无锡市滨湖区2018届九年级第一次模拟考试化学试卷 题型:流程题
浩瀚的大海蕴含的元素有80多种,是一个巨大的宝藏库。地球上99%以上的溴元素都蕴藏在大海中,因此,溴被称为“海洋元素”。工业上常用“空气吹出法”工艺进行海水提溴。因卤水中溴(Br2)的含量较低,必须用工业方法将卤水进行浓缩、提纯从而达到节约成本和能源的目的。“空气吹出法”是目前世界上最成熟、最普遍采用的提溴工艺,此法可从低浓度含溴卤水中提取溴(Br2)。其工艺流程如下:

(1)粗盐中含有多种可溶性杂质如氯化镁、硫酸钠、氯化钙和一些不溶性杂质。粗盐的初步提纯需要先除去不溶性杂质,进行此实验时需要用到的玻璃仪器有烧杯、酒精灯、玻璃棒、量筒、胶头滴管和______。若需要将粗盐精制,则要除净其中的氯化镁、硫酸钠、氯化钙等可溶性杂质,常需用的试剂有:盐酸(过量)、BaCl2溶液(过量)、NaOH溶液(过量)和Na2CO3溶液(过量)。在此精制过程中,滴加过量盐酸的作用是________。
(2)步骤④:含溴(Br2)的空气被SO2吸收会转化成HBr和硫酸,请写出发生反应的化学方程式______。
(3)步骤⑥中的“蒸馏”是一种分离沸点相差较大的液体混合物的方法,根据物质沸点的差异通过控制温度进行分离。蒸馏过程中发生了__________(填“物理”或“化学”)变化。已知溴的沸点是58.5℃,而实际溴出口温度一般控制在80—90℃,温度过高或过低都不利于生产。温度不能过高的原因是______。
(4)氯化后的海水也含有溴单质,为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”,其原因是____________________________________。
漏斗 除去过量的氢氧化钠溶液和碳酸钠溶液 Br2 + SO2 + 2H2O === H2SO4 + 2HBr 物理 温度过高,会产生大量水蒸气,使溴气中水分增加 “空气吹出、SO2吸收、氯化”的过程是一个溴的浓缩过程,与直接蒸馏含溴海水相比,可节约成本和能源。 【解析】(1)粗盐的初步提纯需要先除去不溶性杂质,应该通过过滤除去,过滤时需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和漏斗;氢...查看答案和解析>>
科目:初中化学 来源:甘肃省2018届九年级第一次模拟考试化学试卷 题型:计算题
在含氯化钠杂质的碳酸钠13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与pH的关系如图所示:

(1)100g稀盐酸中氯化氢的质量__.
(2)完全反应后,计算生成二氧化碳的质量为____________?(写出计算步骤)
(3)完全反应后,所得溶液中溶质的质量分数为____________?(写出计算步骤)
7.3g 4.4g 13.5% 【解析】(1)100g稀盐酸中氯化氢的质量=100g=7.3g (2)由图可知,加入100g的稀盐酸后,稀盐酸与碳酸钠恰好完全反应,设生成二氧化碳的质量为x,生成氯化钠的质量为y Na2CO3+2HCl ==2NaCl+H2O+CO2↑ 106 73 117 44 m 7.3g y x ==求得x=4.4g,y=11.7g,m=1...查看答案和解析>>
科目:初中化学 来源:湖北省宜昌市东部2018届九年级下学期期中考试化学试卷 题型:单选题
下列物质中酸性最强的是( )
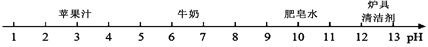
A. 苹果汁 B. 牛奶 C. 肥皂水 D. 炉具清洁剂
A 【解析】溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性,pH越大碱性越强;pH等于7,溶液呈中性。由题中信息可知,苹果汁和牛奶都呈酸性,苹果汁的酸性更强;肥皂水和炉具清洁剂都呈碱性。选A查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com