
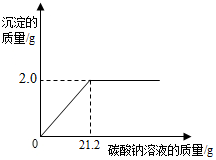
 现有一包只含有氯化钙杂质的粗盐样品.某校化学兴趣小组的同学为测定该粗盐样品中氯化钙的质量分数,称取该粗盐样品10g,充分溶解于100g水中,再滴加适量的碳酸钠溶液,产生沉淀的质量与加入碳酸钠溶液的质量关系如图所示.试计算:
现有一包只含有氯化钙杂质的粗盐样品.某校化学兴趣小组的同学为测定该粗盐样品中氯化钙的质量分数,称取该粗盐样品10g,充分溶解于100g水中,再滴加适量的碳酸钠溶液,产生沉淀的质量与加入碳酸钠溶液的质量关系如图所示.试计算:分析 (1)欲求该粗盐样品中氯化钙的质量分数,须先根据化学方程式求出样品中氯化钙的质量,再利用质量分数公式计算即可.
(2)欲求所的滤液的溶质质量分数,须先根据化学方程式求出溶质的质量,再根据溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%计算即可;此题需根据质量守恒定律求得滤液质量.
解答 解:设粗盐样品中氯化钙的质量为x,生成的NaCl质量为y,则
Na2CO3+CaCl2=CaCO3↓+2NaCl
111 100 117
x 2.0g y
$\frac{111}{x}=\frac{100}{2.0g}=\frac{117}{y}$
解得:x=2.22g,y=2.34g
(1)粗盐样品中氯化钙的质量分数=$\frac{2.22g}{10g}$×100%═22.2%
(2)原混合物中的氯化钠的质量为10g-2.22g,滤液中的氯化钠的质量为10g-2.22g加上生成的氯化钠2.34g,所以为10g-2.22g+2.34g.而溶液的总质量反应前的总质量除了生成沉淀2.0g以外,其余均在溶液.而反应前的总质量为10g+100g+21.2g,后生成沉淀质量为2.0g,所以得到的溶液的质量为10g+100g+21.2g-2.0g
滤液的溶质质量分数=$\frac{10g-2.22g+2.34g}{10g+100g+21.2g-2.0g}$×100%═7.8%
答:粗盐样品中氯化钙的质量分数22.2%;滤液的溶质质量分数7.8%.
点评 本题主要考查学生对物质质量分数和溶质质量分数的计算能力.学生需正确书写出化学方程式,然后根据化学方程式找出比例关系,列出比例式,并正确分析各物质之间的关系,才能正确答题.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 常见的酸溶液:CH3COOH、HCL、H2SO4 | |
| B. | 常见的碱:NaOH、NH3•H2O、KOH | |
| C. | 常见的氧化物:MgO、KMnO4、H2O | |
| D. | 合成材料:合成纤维、塑料盒合成橡胶 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | a | b | m | n |
| 反应前的质量/g | 6.4 | 3.2 | 4.0 | 2.5 |
| 反应后的质量/g | 3.8 | 待测数据 | 7.2 | 2.5 |
| A. | a和b是反应物,n可能是催化剂 | |
| B. | 上表中的“待测数据”的数值为0.6 | |
| C. | m物质中所含元素,一定与A、B两种物质中元素相同 | |
| D. | 该反应一定属于化合反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 两种物质的溶解度都随温度的升高而增大 | |
| B. | 50℃的Na2SO4饱和溶液降到40℃时有晶体析出 | |
| C. | 可用降温结晶的方法提纯含少量Na2SO4的NaCl | |
| D. | 40℃时,Na2SO4饱和溶液的质量分数大于NaCl饱和溶液的质量分数 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
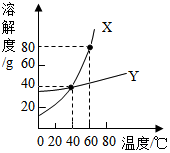 X、Y两种固体物质的溶解度曲线如图所示,回答下列问题:
X、Y两种固体物质的溶解度曲线如图所示,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
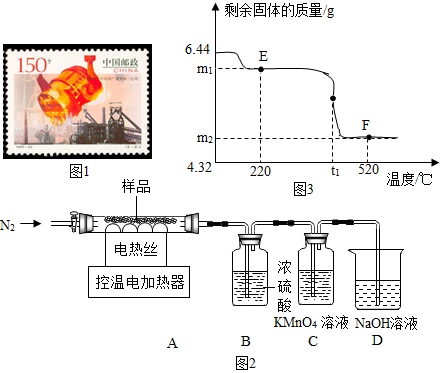
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com