
 某矿泉水标签如图,请填空:
某矿泉水标签如图,请填空:分析 (1)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.
(2)钠离子和氯离子构成的化合物是氯化钠,据此进行分析解答.
(3)根据在化合物中正负化合价代数和为零,结合化合价的表示方法,进行解答.
(4)当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性.
解答 解:(1)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.钙离子可表示为:Ca2+.
(2)钠离子和氯离子构成的化合物是氯化钠,是由钠离子和氯离子构成的化合物,属于盐.
(3)氢元素显+1价,氧元素显-2价,设硅元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×3=0,则x=+4价;由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,故偏硅酸(H2SiO3)中硅元素的化合价可表示为:H2$\stackrel{+4}{Si}$O3.
(4)该矿泉水的pH为7.3-8.2,大于7,显碱性.
故答案为:(1)Ca2+;(2)盐;(3)H2$\stackrel{+4}{Si}$O3;(4)碱性.
点评 本题难度不大,掌握离子符号的表示方法、盐的特征、化合价的计算与表示方法、溶液的酸碱性和溶液pH大小之间的关系是正确解答本题的关键.


 口算能手系列答案
口算能手系列答案科目:初中化学 来源: 题型:解答题
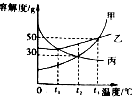 甲、乙、丙三种固体物质的溶解度曲线如图所示,请根据图示回答下列问题.
甲、乙、丙三种固体物质的溶解度曲线如图所示,请根据图示回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
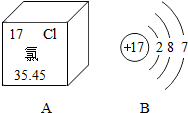 图A是氯元素在元素周期表中的部分信息,图B是氯原子的结构示意图,据此回答问题.
图A是氯元素在元素周期表中的部分信息,图B是氯原子的结构示意图,据此回答问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 空气 | NH3 | CH4 | HCl | O2 | |
| 密度/gL-1 | 1.293 | 0.771 | 0.717 | 1.629 | 1.43 |
| 溶解性 | -- | 极易溶 | 难溶 | 极易溶 | 难溶 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 溶液中的溶质可能是多种 | |
| B. | 不饱和溶液也可能是浓溶液 | |
| C. | 均一、稳定的液体一定是溶液 | |
| D. | 饱和溶液析出晶体后,溶质质量分数可能不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
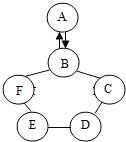 如图所示的是物质A~F是初中化学常见的几种物质.相互间的关系“→”表示物质间存在的转化关系,“-”表示两端的物质能发生化学反应.A是一种红色固体,B→A的过程较为缓慢、复杂;C的溶液呈蓝色;E在工业上广泛用于玻璃、造纸、纺织和洗涤剂生产等领域.
如图所示的是物质A~F是初中化学常见的几种物质.相互间的关系“→”表示物质间存在的转化关系,“-”表示两端的物质能发生化学反应.A是一种红色固体,B→A的过程较为缓慢、复杂;C的溶液呈蓝色;E在工业上广泛用于玻璃、造纸、纺织和洗涤剂生产等领域.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图所示是A~F相互间的关系,如用“→“表示物质间存在转化关系,“用“-”表示两端的物质能发生化学反应.已知A、E是初中阶段常见的两种氧化物,在通常情况下E为气体,A为红棕色固体,B为金属单质,C的水溶液为蓝色.C、D、F又分别属于酸、碱、盐中的一种,且都含有请结合初中多学知识回答下列问题:
如图所示是A~F相互间的关系,如用“→“表示物质间存在转化关系,“用“-”表示两端的物质能发生化学反应.已知A、E是初中阶段常见的两种氧化物,在通常情况下E为气体,A为红棕色固体,B为金属单质,C的水溶液为蓝色.C、D、F又分别属于酸、碱、盐中的一种,且都含有请结合初中多学知识回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 步骤 | 实验操作 | 预期现象与结论 |
| 1 | 各取2mL反应后的混合溶液分别加入A、B两只试管 | / |
| 2 | 向A试管中滴加足量的稀硫酸,随即滴入几滴红色品红溶液 | 产生气泡,品红溶液褪色.证明含有K2SO3 |
| 3 | 向B试管中,加入足量氯化钡溶液,再加入足量的稀盐酸 | 先有白色沉淀,后有气体产生,沉淀部分溶解,证明含有 K2SO4,则猜想3成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com