
分析 (1)若把混合物看成1,混合物中氧元素的质量分数=1-混合物中硫元素的质量分数-镁元素的质量分数-钠元素的质量分数-氢元素的质量分数;由于Na和H的相对原子质量的和等于Mg的相对原子质量,抛开元素仅从数字的角度来看,“NaH”与Mg相等,所以可以从质量角度将“NaH”视为一个与Mg等效的整体A(即将“NaH”和Mg都换用“A”来表示,可看作其相对原子质量为24).那么,这样处理后混合物就相当于是由AS、ASO4、ASO3组成的了,混合物中氧元素的质量分数=1-混合物中硫元素的质量分数-A元素的质量分数;而此时的混合物中A、S原子个数比为1:1,二者的质量比为24:32;利用硫元素的质量分数可求得A的质量分数,从而计算出混合物中氧元素质量分数.
(2)已知Mg→MgSO4; Zn→ZnSO4; Fe→FeSO4.并且可知道,这个变化中,增加的质量是硫酸根的质量218g-50g=168g,在H2SO4中 氢元素与硫酸根的质量比为2:96.
解答 解:(1)由于Na和H的相对原子质量和等于Mg的相对原子质量,所以可以从质量角度将“NaH”视为一个与Mg等效的整体A(即将“NaH”和Mg都换用“A”来表示,其相对原子质量可作24).
根据A、S质量比为24:32以及硫的质量分数为a,设A的质量分数为x,则有24:32=x:a,解之得,混合物中A的质量分数为$\frac{3}{4}$a,
氧的质量分数为1-a-$\frac{3}{4}$a=1-1.75a;
故填:1-1.75a.
(2)设生成氢气的质量为x,根据关系式A→ASO4→SO4→H2↑,
96 2
168g x
则$\frac{2}{96}=\frac{x}{168g}$
x=3.5g;
故答案为:3.5g.
点评 根据物质组成元素的特点,利用数学的技巧处理复杂的化学计算,是解决此类问题所需要的能力.


科目:初中化学 来源: 题型:选择题
| A. | 化工企业需要大量的水 | |
| B. | 便于向长江内大量排污水 | |
| C. | 便于原材料和产品的运输 | |
| D. | 减少化工企业生产过程中三废对人口稠密地区的危害 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
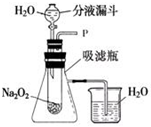 在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.
在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 如图所示,电源电压恒定,甲、乙两杯中分别倒入相同质量分数的稀H2SO4,合上开关后,发现 V1、V2表读数U1、U2相同,小灯泡正常发光,下面说法正确的是( )
如图所示,电源电压恒定,甲、乙两杯中分别倒入相同质量分数的稀H2SO4,合上开关后,发现 V1、V2表读数U1、U2相同,小灯泡正常发光,下面说法正确的是( )| A. | 若将甲溶液中的两极靠近,会发现U2变小 | |
| B. | 若往乙溶液中滴入少量Ba(OH)2溶液,会发现U2变小 | |
| C. | 若往甲溶液中逐渐滴入Ba(OH)2溶液直到过量,小灯泡先变暗后变亮 | |
| D. | 溶液导电的原因是通电后稀H2SO4发生电离的缘故 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体放于试管中,滴加足量的稀盐酸. | 固体逐渐消失,有无色气体产生,得到浅绿色溶液. | 固体中一定含有Fe,一定不含Fe2O3. |
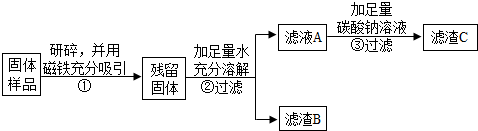
| 实验操作 | 实验现象 | 实验结论 |
| ①取滤渣B于试管中,加入适量稀盐酸 ②生成的气体通入澄清石灰水 | ①有气泡冒出 溶液变为黄色②该溶液变浑浊. | 固体中一定含有CaCO3和Fe2O3. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验分析与结论 |
| 取打磨后的“锡纸”片放入试管中,滴加氯化锌溶液 | “锡纸”表面有深灰色固体析出 | 根据实验现象,结合金属活动性顺序可知猜想 Ⅱ(填“Ⅰ”或“Ⅱ”)成立;反应的化学方程式为2Al+3ZnCl2=3Zn+2AlCl3. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com