
分析 (1)根据该反应中只有二氧化碳是气体,则利用质量守恒定律和反应前后烧杯中物质的总质量之差来计算二氧化碳的质量;
(2)利用化学反应方程式计算出氯化钙的质量,再利用溶液的质量来计算溶质的质量分数.
解答 解:(1)由质量守恒可知,二氧化碳的质量为22.2g+126g-139.4g=8.8g;
(2)设碳酸钙的质量为x,生成的氯化钙的质量为y,
则CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 111 44
x y 8.8g
$\frac{100}{x}$=$\frac{111}{y}$=$\frac{44}{8.8g}$
x=20g
y=22.2g
因杂质既不溶于水,也不与其他物质反应,则溶液的质量为139.4g-(22.2g-20g)=137.2g,溶质的质量为22.2g,
则溶质的质量分数为:$\frac{22.2g}{137.2g}$×100%≈16.1%.
故答案为:(1)生成二氧化碳的质量8.8g;
(2)反应后所得溶液中溶质的质量分数16.1%.
点评 本题考查学生利用化学反应方程式的计算,明确二氧化碳是气体并利用质量守恒来计算二氧化碳的质量是解答的关键.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:初中化学 来源: 题型:填空题
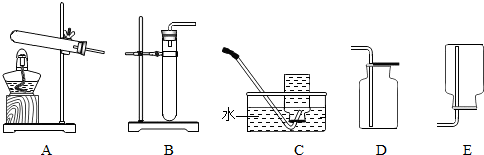
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 青蒿素属于无机化合物 | |
| B. | 青蒿素分子的相对分子质量为282g | |
| C. | 青蒿素中碳、氢、氧三种元素的质量比为15:22:5 | |
| D. | 青蒿素中氢元素的质量分数为7.8% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
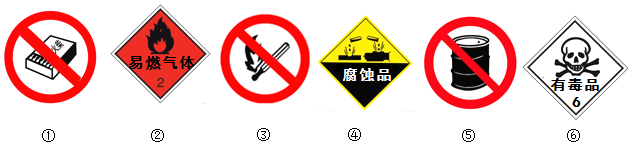
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| NH4Cl溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
| NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| A. | 20℃时,氯化钠饱和溶液的溶质质量分数为36% | |
| B. | 由表中数据可知,溶解度受温度变化影响较大的物质是氯化钠 | |
| C. | 氯化钠与氯化铵溶解度相等的温度在10℃-20℃之间 | |
| D. | 50℃时,100g水中加入50.0g氯化铵配成溶液,再冷却到20℃,能够析出13.2g固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com