铜和铁是生产、生活中广泛使用的金属.
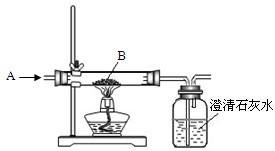
(1)下图是工业炼铁原理的实验示意图.气体A是______和红棕色粉末B是______.广口瓶中可观察到的现象是______;用化学方程式表示炼铁的反应原理是______ 2Fe+3CO2
【答案】
分析:(1)根据实验室用一氧化碳还原氧化铁的反应原理和操作注意事项分析即可;
(2)根据铁生锈的原理和铜绿的成分分析即可;
(3)因为生锈铜片的表面的主要成分为 Cu
2(OH)
2CO
3,根据实验流程图并结合Cu
2(OH)
2CO
3与稀硫酸的反应原理,再根据铁粉与硫酸铜、铁粉与稀硫酸的反应原理分析即可.
解答:解:(1)用一氧化碳还原红棕色的氧化铁粉末,同时生成二氧化碳,二氧化碳可以使澄清石灰水变浑浊,实验过程中未反应的一氧化碳有毒,不能直接排入空气中,可以将其点燃或收集起来.
故选CO Fe
2O
3澄清石灰水变浑浊 Fe
2O
3+CO

2Fe+3CO
2点燃或用气球收集
(2)铁在潮湿的空气中生锈生成铁锈,铜在潮湿的空气中也会生锈,生成铜绿,铜绿的主要成分是碱式碳酸铜,
化学式是Cu
2(OH)
2CO
3
故答案为:与潮湿的空气接触 Cu
2(OH)
2CO
3
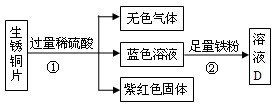
(3)该实验流程为:生锈铜片表面的主要成分是 Cu
2(OH)
2CO
3,它可以与硫酸反应生成二氧化碳无色气体、蓝色的硫酸铜溶液,当表面的铜锈反应完全后露出红色的铜;蓝色的硫酸铜溶液中还有未反应完的稀硫酸,所以向蓝色的硫酸铜溶液中加入铁粉时,铁既会与硫酸铜溶液反应又会与稀硫酸反应.
故选Cu Fe+CuSO
4═FeSO
4+Cu,Fe+H
2SO
4═FeSO
4+H
2↑
点评:在做实验流程题时要注意所给的试剂是否过量.如该实验流程中所给的稀硫酸就是过量的,所加的铁粉除与硫酸铜溶液反应外还与剩余的稀硫酸反应.

 2Fe+3CO2点燃或用气球收集
2Fe+3CO2点燃或用气球收集