
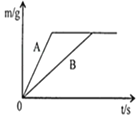
【题目】将等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸中,生成氢气质量(m)随反应时间(t)的变化曲线如图所示,对于该图象的理解,有下列说法,其中正确的是( )
①B表示铁和稀硫酸的反应曲线
②反应结束后铁一定有剩余锌可能有剩余
③反应结束后消耗的稀硫酸质量相等
④反应结束后生成氢气的质量相等
⑤反应结束后所得溶液质量相等。
A. ①③④B. ①③⑤C. ①②③④D. ②④⑤
【答案】C
【解析】
根据等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸充分反应
①锌的活动性比铁的活动性强,等质量的金属,锌反应的时间短;②由图示可知:生成的氢气的质量相等,所以硫酸均反应完;由方程式分析,二者反应结束后,可能金属都有剩余,也可能锌恰好反应完,铁有剩余;③由图示可知:生成的氢气的质量相等,所以硫酸均反应完;④由方程式分析可知:相等质量的铁和锌与硫酸反应,铁生成氢气多;⑤依据质量守恒定律,反应后溶液的质量=反应前的总质量-气体的质量-不溶物的质量,图示中生成氢气的质量相等,但剩余的不溶物的质量不同,所以反应结束后所得溶液质量不相等。
①锌的活动性比铁的活动性强,等质量的金属,锌反应的时间短,故正确;②根据化学方程式![]() ,可知每56g铁生成2g氢气,根据化学方程式
,可知每56g铁生成2g氢气,根据化学方程式![]() ,可知每65g锌反应生成2g氢气;由方程式分析可知,二者反应结束后,生成相等质量的氢气消耗的金属的质量不相等,可能金属都有剩余,也可能锌恰好反应完,铁有剩余,故正确;③置换反应是金属置换酸中的氢元素,所以若生成的氢气的质量相等,硫酸质量相等,故正确;④由方程式分析可知,二者反应结束后,生成相等质量的氢气,故正确;⑤由方程式分析可知,二者反应结束后,生成相等质量的氢气消耗的金属的金属不相等,所得溶液的质量一定不相等,故错误。
,可知每65g锌反应生成2g氢气;由方程式分析可知,二者反应结束后,生成相等质量的氢气消耗的金属的质量不相等,可能金属都有剩余,也可能锌恰好反应完,铁有剩余,故正确;③置换反应是金属置换酸中的氢元素,所以若生成的氢气的质量相等,硫酸质量相等,故正确;④由方程式分析可知,二者反应结束后,生成相等质量的氢气,故正确;⑤由方程式分析可知,二者反应结束后,生成相等质量的氢气消耗的金属的金属不相等,所得溶液的质量一定不相等,故错误。


科目:初中化学 来源: 题型:
【题目】生产、生活、科技、环保等都离不开化学
(1)能源、环境与人类的生活和社会发展密切相关。
①目前,人类以化石燃料为主要能源,常见的化石燃料包括煤、石油和_____。
②为减少污染、提高煤的利用率,可将其转化为可燃性气体水煤气,此过程可认为是碳与水的反应,其微观示意图如下所示:
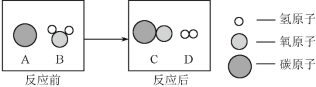
该反应的基本反应类型为_____;该反应生成物的分子个数比为_____。
③水煤气在不同催化剂作用下,可以合成不同物质,如重要有机物甲醇(CH3OH),写出该反应的化学方程式_____。有人认为仅利用水煤气在催化剂作用下不能合成尿素〔CO(NH2)2〕,理由是_____。
(2)糖类、油脂、蛋白质都是人体必需的营养物质,合理膳食是健康的基本保证。
①食物的成分主要有蛋白质、_____、油脂、维生素、无机盐和水等六大类,通常称为营养素。下列食品中富含蛋白质的是_____(填写序号)。
A菠菜 B鸡蛋 C花生油 D米饭E牛奶
②黄瓜中富含维生素C,维生素C在pH<5和低温的环境中较稳定,为减少维生素C的损失,食用黄瓜的最佳方法是_____。
(3)材料是人类赖以生存的重要物质基础。材料种类很多,通常可分为金属材料、无机非金属材料、高分子合成材料及复合材料。
①铁锅、铝锅、铜锅用来炒菜、做饭是利用了它们的_____。金属的使用早晚与其活动性有着密切的关系。利用下列试剂与上面三种金属来探究它们的金属活动性顺序,能达到目的是_____(填序号)。
A硫酸铝溶液 B.硫酸亚铁溶液 C硫酸铜溶液
②下列有关合金性质的说法正确的是_____(填字母)。
A合金的熔点一般比它的成分金属高
B合金的硬度一般比它的成分金属低
C组成合金的元素种类相同,合金的性能就一定相同
D合金与各成分金属相比,具有许多优良的物理、化学或机械性能
③下列对金属制品采取的防护方法不正确的是_____(填序号)。
A在电线的外面包上一层塑料层 B在自行车钢圈上镀上一层金属铬 C在海轮的铁制外壳上焊上铜
④合成塑料、合成橡胶和_____是常说的三大合成材料。下列制品中含有合成橡胶的是_____(填字母)。
A汽车轮胎 B涤纶 C聚氯乙烯制品 D玻璃钢
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组同学对长期露置于空气中的化学药品成分变化情况做了以下探究。
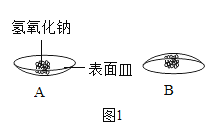
(1)取少量氢氧化钠固体置于表面皿上,几分钟后将表面皿倒置现象如图1B所示,通过细致观察发现氢氧化钠_____。放置几天以后,观察到图IC中的现象,为检验氢氧化钠是否完全变质,小组同学设计了下列实验。
实验操作 | 实验现象 | 结论 |
① _____ | 生成白色沉淀 | 药品 部分变质 |
②待①中反应恰好完全时静置,取上层清液溶液少许于试管中,滴加几滴酚酞溶液 | 溶液由无色变部分变质 成红色 |
(2)①中发生的化学反应方程式是_____。
(3)盐酸与空气成分均不发生化学反应,所以久置盐酸中的物质种类不会发生变化。
同学们对久置稀盐酸溶质质量分数的变化情况开展了探究。
I.提出猜想:猜想一:溶质质量分数不变
想二:溶质质量分数减小
猜想三:溶质质量分数_____。
Ⅱ.实验准备
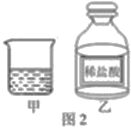
该小组在实验室配制了一定浓度的稀盐酸分装在甲烧杯和乙试剂瓶中,塞好乙瓶的瓶塞(如图2)。置于相同环境中,放置一段时间。
Ⅲ.设计方案,并完成实验,记录如表所示
实验操作 | 实验现象 | 实验结论 | |
方案一 | 取等质量等浓度的NaOH溶液于两个锥形瓶中,均加3滴酚酞 溶液,分别滴加甲、乙中的稀盐酸,记录消耗稀盐酸的质量 | ①溶液时,消耗稀盐酸的质量: 甲<乙 | 猜想三 |
方案二 | 分别取少量甲、乙中稀盐酸于试管中,用玻璃棒蘸取滴在置于表面皿中的用pH试纸上,与标准比色卡对照 | ②pH值:甲_____乙 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】草酸存在于自然界的植物中。草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。草酸能与氢氧化钙反应生成沉淀:H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.请回答下列问题:
(1)甲组同学按照如图1所示的装置,通过实验检验草酸晶体的分解产物。仪器a的名称是_____。装置B的主要作用是_____。装置C中有气泡逸出,澄清石灰水变浑浊。由此可知草酸晶体分解的产物中一定有_____。
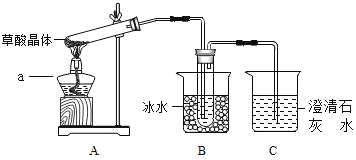
(2)乙组同学认为草酸晶体分解的产物中还有CO.为进行验证,选用甲组实验中的装置A、B和图2所示的部分装置(可以重复选用)进行实验。
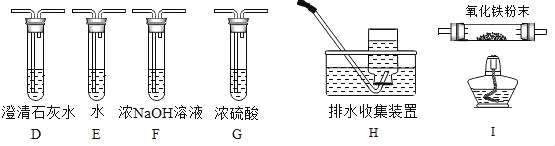
①乙组同学的实验装置依次连接的合理顺序为A→B→_____→I→D→H。
甲:F→D→G 乙:G→F→D 丙:D→F→G 丁:D→G→F
在上述装置中,F装置的作用是_____;H装置的作用是_____。
②装置I中盛有的氧化铁发生了颜色变化,欲证明草酸晶体分解的产物中有CO,乙组同学需要两次使用装置D,其现象分别是第一个D装置_____;第二个D装置_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在宏观、微观和符号之间建立联系是化学特有的思维方式。
(1)在氧气、铁和氯化钠三种物质中,保持氧气化学性质的最小粒子是___________;由离子构成的物质是__________________。
(2)某化学反应的微观示意图如下:
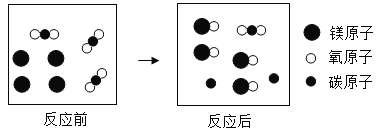
①反应涉及到的物质中,![]() 是由___________(填“分子”、“原子”或“离子”)构或的单质,有____________种氧化物.
是由___________(填“分子”、“原子”或“离子”)构或的单质,有____________种氧化物.
②参加反应的![]() 和
和![]() 的微粒个数比是____________(写出最简整数比)
的微粒个数比是____________(写出最简整数比)
③反应生成的单质和化合物的质量比是_______________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】淮安市区至淮安区的轻轨正在紧张建设中,建设轻轨用到大量的金属材料。下图是高炉炼铁和炼铁原理的相关实验。
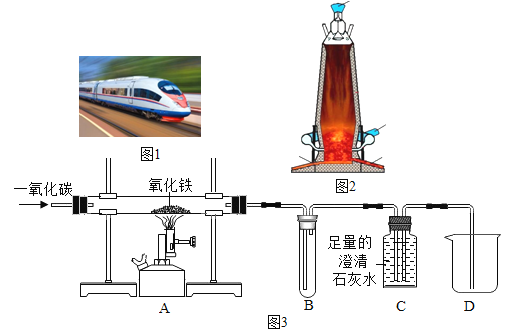
(1)如图1,列车用了大量铝合金材料,铝制品抗腐蚀性能很好,原因是_____。
(2)图2是高炉炼铁的示意图,高炉炼铁需要的原料有铁矿石、焦炭、石灰石和空气,其中焦炭的作用是燃烧产生热量维持炉温和_____。
(3)某同学用图3装置,一氧化碳还原氧化铁的实验。在完成气密性检查后加入药品。给氧化铁加热前要先向装置中通一会儿一氧化碳,目的是_____,实验过程中玻璃管A中的实验现象为_____,化学方程式为_____。
(4)有同学认为该装置需要添加尾气处理装置,你认为是否需要并说明理由_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类的日常生活和生产离不开水。
(1)饮用硬度或酸碱度过大的水都不利于人体健康。生活中可通过_____方法来降低水的硬度。在实验室里常用_____来测定水的酸碱度;
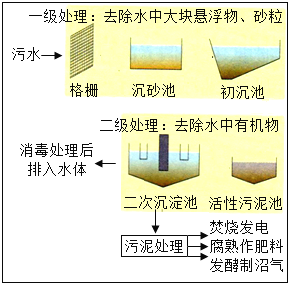
(2)如图为某种污水处理流程示意图。水通过“格栅”可去除较大的悬浮物、漂浮物,相当于基本实验操作中的_____。消毒处理属于_____(选填“物理”或“化学”)变化。消毒处理后的某无色透明水样中含有钾盐,证明此水样为混合物简单的方法是_____(写出操作、现象)
(3)极少部分水分子在特定条件下容易解离而得到H+和OH﹣,H+易与水分子形成水合氢离子 (H3O+),与水分子相比,下列对水合氢离子描述不合理的是_____(填字母序号)
A 氧元素的化合价发生了改变
B 微粒的构成发生了改变
C 微粒的化学性质发生了改变
D 微粒的电子数发生了改变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分析处理图表中的信息是学习化学的一种重要方法。
(1)如表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
Ⅰ.20℃时,NaCl的溶解度是_____g。
Ⅱ.30℃时,KNO3溶液的最大浓度(溶质质量分数)为_____(只列计算式,不需要计算结果)。
Ⅲ.KNO3 中含少量氯化钠时,提纯硝酸钾的一般方法是_____。
Ⅳ.根据表内数据可知,KNO3和NaCl在某一温度时具有相同的溶解度X,则X的取值范围是_____。
(2)如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答。
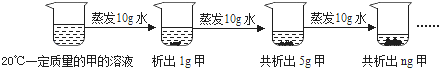
Ⅰ.蒸发前原溶液是_____(填“饱和”或“不饱和”)溶液。n的数值是_____。
Ⅱ.依据上述实验,你认为甲的溶解度随温度变化的趋势是_____(填字母)。
A 随温度升高而增大 B 随温度升高而减小 C 无法判断
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用所学知识回答下列问题。
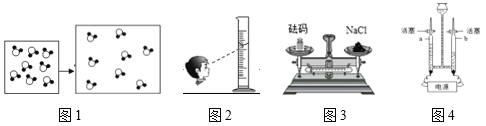
(1)图1表示的是某物质发生某变化的微观示意图,发生该变化的条件是_____(填一个)
(2)按图2方式量取了20mL水用于稀释浓硫酸,稀释后的实际浓度_____稀释后的理论浓度(填>、<或=)。
(3)按图3称量3.0g氯化钠(1g以下用游码)。实际称得的氯化钠的质量_____3.0g(填>、<或=)。
(4)图4所示的实验结束后,a管所收集到气体的质量与b管所收集到气体的质量比为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com