
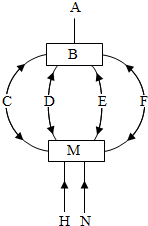
 以下五种为初中常见物质,均由表中元素组成
以下五种为初中常见物质,均由表中元素组成 | 元素名称 | 氢 | 碳 | 氧 | 氯 | 钙 | 铁 |
| 元素符号 | H | C | O | Cl | Ca | Fe |
| ||
| ||


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
A、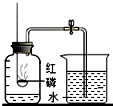 氧气约占空气体积的
| ||
B、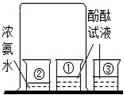 证明分子是不断运动的 | ||
C、 天平不平衡说明该反应不遵守质量守恒定律 | ||
D、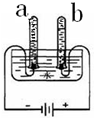 氢气与氧气的体积比为2:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
A、 向一定量石灰石中滴加稀盐酸 |
B、 向一定量的过氧化氯溶液中加入少量二氧化锰 |
C、 向相同质量的铁粉和锌粉中分别加入足量稀盐酸 |
D、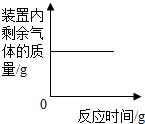 在某一密闭容器内点燃红磷 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 反应时间(秒) | 20 | 40 | 60 | 80 | 100 | 120 | 140 | |
| 收集到的气体体积(毫升) | 甲金属 | 25 | 60 | 95 | 130 | 160 | 170 | 170 |
| 乙金属 | 30 | 75 | 120 | 150 | 150 | 150 | 150 | |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com