
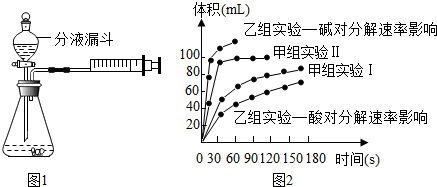
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 探究 | 25℃ | 二氧化锰 | 10mL 2%H2O2 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
| ||
| ||


科目:初中化学 来源: 题型:
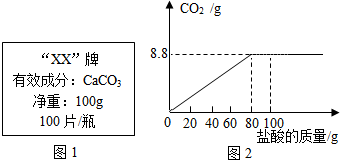
| 第1次 | 第3次 | 第4次 | |
| 加入盐酸的质量(g) | 20 | 20 | 20 |
| 剩余固体的质量(g) | 35 | a | 20 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 物质的组成与性能 | 用于食品添加剂 | |||
| 物质名称 | 物质组成 | 主要化学性质及在体内变化 | 类别或作用 | 法律规定 |
| 碳酸氢钠 | NaHCO3 | 无毒、弱碱性,易与胃酸反应,加热分解成碳酸钠、水和二氧化碳 | 膨松剂 | 可用 |
| 铁 (还原性铁粉) | Fe | 比较活泼的金属,能与胃酸反应 | 抗氧化剂 | 依据国家标准可用 |
| 食盐 | NaCl | 易溶、中性,与硝酸银溶液反应生成白色沉淀 | 调味剂 | 可用 |
| 甲醛 | CH2O | 防腐 | 国家严禁使用 | |
| 亚硝酸钠 | NaNO2 | 易溶、水溶液显碱性,跟硝酸银反应生成浅黄色沉淀 | 发色剂、防腐剂 | 严格依据国家标准 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
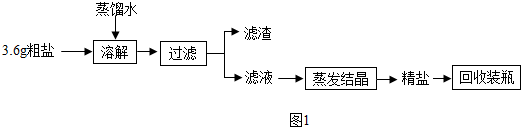
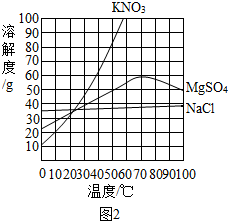
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com