
分析 (1)pH=7的溶液是中性溶液,pH<7的溶液是酸性溶液,pH>7的溶液为碱性溶液.
(2)酸性土壤中加入熟石灰可以使土壤酸性降低,有利于农作物的生长.
(3)铁在金属活动性顺序表中,位于铜的前面,能与硫酸铜发生置换反应.
解答 解:(1)胡柚适宜生长在pH为5.5~6.5的土壤环境中,呈酸性,故填:偏酸性;
(2)土壤pH为5.5~4.8,而胡柚适宜生长在pH为5.5~6.5的土壤环境中,故需要降低土壤的酸性,可以加入碱性物质,氢氧化钙具有碱性,可以用于改良酸性土壤,故填:撒适量熟石灰;
(3)铁能与波尔多液中的硫酸铜反应生成硫酸亚铁和铜,导致药效降低,故填:Fe+CuSO4=FeSO4+Cu.
点评 本题考查了溶液的酸碱性与pH的关系以及金属的有关知识,完成此题,可以依据已有的知识进行.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出2克合金样品,每次加入稀硫酸10克,共加入稀硫酸4次,充分反应后,过滤、洗涤、干燥、称重,得到的实验数据如图所示:
某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出2克合金样品,每次加入稀硫酸10克,共加入稀硫酸4次,充分反应后,过滤、洗涤、干燥、称重,得到的实验数据如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| ①实验操作 | ②实验现象 |
| 剪下一片变黑的铜片,放入试管中, 通入足量的一氧化碳气体 | 铜片表面的黑色物质全部消失,露出红色的铜,将生成的气体通入澄清石灰水,石灰水变浑浊 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
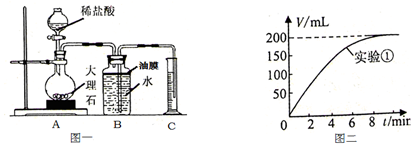
| 实验序号 | 温度(℃) | 大理石颗粒 | 盐酸质量分数(%) | 实验目的 |
| 1 | 20 | 粗 | 5 | 探究大理石和盐酸的反应速度与石灰石颗粒大小的关系 |
| 2 | 20 | 细 | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com