
【题目】请根据图回答问题:
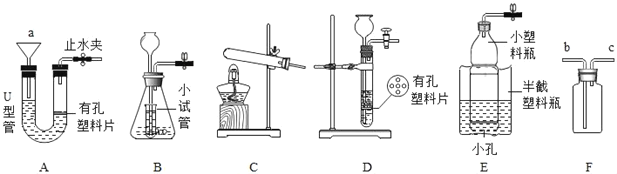
(1)仪器a的名称是__;图中可用于加热高锰酸钾制备氧气的装置为__(填序号),化学反应方程式为__。
(2)实验室若用A装置中制备二氧化碳气体,其化学反应方程式为___。若在反应进行中将A装置的橡胶管中部用止水夹夹住,可能出现的现象是___。
(3)检验装置D气密性的方法是:用止水夹夹紧导管口的橡胶管后,___,则气密性良好。
(4)若用过氧化氢溶液制备O2,最好选用装置__(填序号),其化学反应方程式为__。把F装满水,用排水法收集O2并测定气体体积,O2导入端应在__端(填“b”或“c”),在另一端则需要连接上一个__(填仪器名称)。
【答案】漏斗 C 2KMnO4![]() K2MnO4+MnO2+O2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ 液体和固体分离,反应停止 向长颈漏斗中加入一定量水,若水面下降到一定程度后能稳定保持液面不再下降 B 2H2O2
K2MnO4+MnO2+O2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ 液体和固体分离,反应停止 向长颈漏斗中加入一定量水,若水面下降到一定程度后能稳定保持液面不再下降 B 2H2O2![]() 2H2O+O2↑ c 量筒
2H2O+O2↑ c 量筒
【解析】
(1)仪器a的名称是漏斗,如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;故填:漏斗;C;2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(2)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,因此不需要加热;若在反应进行中将A装置的橡胶管中部用止水夹夹住,可能出现的现象是:液体和固体分离,反应停止;故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;液体和固体分离,反应停止
(3)检验装置D气密性的方法是:用止水夹夹紧导管口的橡胶管后,向长颈漏斗中加入一定量水,若水面下降到一定程度后能稳定保持液面不再下降,则气密性良好;故填:向长颈漏斗中加入一定量水,若水面下降到一定程度后能稳定保持液面不再下降
(4)如果用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,要注意配平;把F装满水,用排水法收集O2并测定气体体积,O2导入端应在短管,因为氧气的密度比水小,在另一端则需要连接上一个量筒;故填:B;2H2O2![]() 2H2O+O2↑;c;量筒。
2H2O+O2↑;c;量筒。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:初中化学 来源: 题型:
【题目】已知氯化钾、硝酸钾在不同温度时的溶解度如下表:
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | 氯化钾 | 27.6 | 34.0 | 40.0 | 45.5 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110.0 | |
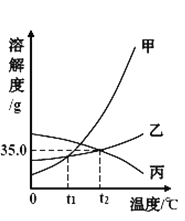
依据上表数据和溶解度曲线判断,下列说法错误的是
A. 能表示硝酸钾和氯化钾的溶解度曲线分别是甲和乙
B. t1℃时,氯化钾和硝酸钾的溶解度相等,在 34.0 g 至 35.0 g 之间
C. t2℃时,将接近饱和的丙物质的溶液升高温度,可使其变成饱和溶液
D. 氯化钾中混有少量的硝酸钾,可采用降温结晶的方法提纯
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上生产镀铜电路板及处理废液的工艺流程如下:

(1)由步骤①可判断FeCl3与铜反应生成的两种产物是FeCl2和___。
(2)步骤②加入过量的铁粉,除能与废液中FeCl3反应外,还可发生反应的化学方程式为__,滤渣是___和___。
(3)步骤③加入稀盐酸,充分搅拌,当观察到___现象时,说明滤渣只剩铜。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在粗盐的提纯实验中
(1)其主要操作步骤顺序是________________。
①过滤 ②溶解 ③蒸发 ④计算产率
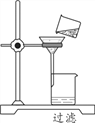
(2)下图是某同学过滤的操作图,指出图中明显错误______;过滤后,如果滤液仍然浑浊,其原因可能是__________。(填一种)
(3)蒸发时,蒸发皿内出现________ 时应停止加热。
(4)通过以上操作只能除去粗盐中难溶性杂质,欲除去可溶性杂质MgCl2、CaCl2得到纯净的NaCl,可采用如下图所示流程:
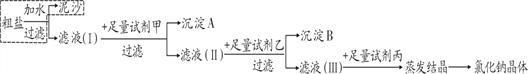
①上图中所用甲、乙、丙三种试剂依次是__________。
A.NaOH溶液、Na2CO3溶液、稀盐酸
B.Na2CO3溶液、KOH溶液、稀盐酸
C.NaOH溶液、Na2CO3溶液、稀硫酸
②反思交流:通过以上规范操作,制得氯化钠的质量比原粗盐样品中含氯化钠的质量______(填“增多”、“减少”、“不变”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】NaOH潮解后极易与空气中的CO2反应生成Na2CO3而变质.为测定实验室一瓶放置已久的烧碱中NaOH含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g.请计算:
(1)反应产生的CO2的质量为___g.
(2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是_____?
(3)用同浓度的硫酸,与一瓶未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等.其原因是:__(从钠元素质量守恒的角度解释).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】.在生产生活中,你会发现“化学就在身边”.
(1)上海世博园内安装的“直饮水”机,采用“活性炭+超滤层+紫外线”净水工艺.活性炭在此起_____作用,净化后的水属于_____(选填“混合物”或“纯净物”).
(2)在农业生产中,施用的草木灰(有效成份为K2CO3)属于_____肥.
(3)在含有硫酸镁、硫酸铜的工业废水中加入过量的锌粉,充分反应后过滤,所得固体是(填写化学式)_____.
(4)化学为体育不仅雪中送炭,而且锦上添花.举重、体操等项目的运动员在比赛前常用白色的“镁粉”搓手,这是因为“镁粉”质轻、吸水性好,可做防滑剂.“镁粉”的有效成份是碱式碳酸镁,它不可燃,300℃即分解,其分解的化学方程式是:
Mg5(OH)2(CO3)4![]() 5MgO+X+4CO2↑,则X的化学式是_____;根据这些信息,还能推断出“镁粉”的另一种用途是_____.
5MgO+X+4CO2↑,则X的化学式是_____;根据这些信息,还能推断出“镁粉”的另一种用途是_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是以黄铜矿(主要成分为CuFeS2)为原料制取胆矾晶体(CuSO45H2O)的流程:
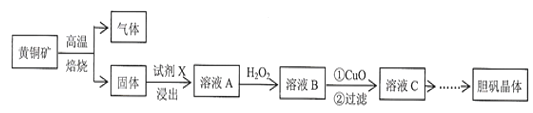
已知:高温焙烧时的主要反应有:2CuFeS2+O2![]() Cu2S+2FeS+SO2;
Cu2S+2FeS+SO2;
2Cu2S+ 5O2![]() 2CuO+2CuSO4,2FeS+3O2
2CuO+2CuSO4,2FeS+3O2![]() 2FeO+2SO2
2FeO+2SO2
(1)最适合的试剂X是__________________(填化学式)溶液。(x足量,能完成后续反应)
(2)加入适量 CuO粉末的作用是调节溶液的pH,促进 Fe3+水解产生氢氧化铁,达到除杂的目的。由溶液C制胆矾晶体包含的主要操作步骤是_______、_______、过滤、晾干。
(3)假设流程图中消耗的CuO为ag,最终制得bg胆矾晶体,消耗黄铜矿的质量为cg,不考虑生产过程中的损失,则黄铜矿中CuFeS2的质量分数为____________(列出计算式)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类社会的发展离不开常见金属和金属材料,用我们学到的化学知识和方法能分析和解释许多现象。
(1)下列生活用品,主要利用金属具有良好导热性的是________________。
A  B
B  C
C  D
D 
(2)常见的三种金属被发现、使用的先后顺序依次为铜、铁、铝。金属大规模被使用的先后顺序跟下列____(填序号)关系最大。
①地壳中金属元素的含量
②金属的导电性
③金属活动性
(3)工业上用赤铁矿(主要成分为氧化铁)炼铁的化学反应方程式为_____________________;世界上每年有近四分之一的钢铁被锈蚀,为了保护金属资源我们必须学会防锈,下列介绍的实例只利用隔绝氧气来达到防锈的是______________________________________________。
A  B
B ![]() C
C  D
D 
(4)工业生产中,切割铁板时用硫酸铜溶液在铁板上画线可留下红色的印迹。有关反应的化学方程式为________________________________________。
(5)铁粉常用作双吸剂,将一包部分变质的双吸剂放入过量稀盐酸中,充分反应后所得溶液中的溶质可能是________________(友情提示:在溶液中可发生Fe+2FeCl3===3FeCl2反应)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com