
| 实验 | 操作步骤 | 实验现象 | 实验结论 |
| 1 | 切开蜡烛,取出打火石,用砂纸打磨 | 打火石呈银白色 | 该金属一定不是 |
| 2 | 取少量打磨后的打火石于试管中,滴加稀盐酸 | 有无色气体产生, | 该金属一定不是铁,而是镁 |
| 实验 | 操作步骤 | 实验现象 | 实验结论 |
| 1 | 切开蜡烛,取出打火石,用砂纸打磨 | 打火石呈银白色 | 该金属一定不是铜 |
| 2 | 取少量打磨后的打火石于试管中,滴加稀盐酸 | 有无色气体产生,溶液为无色 | 该金属一定不是铁,而是镁 |


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
| A、分子是构成物质的微粒,物质都是由分子构成的 |
| B、碱性较强的溶液能使酚酞溶液变红,能使酚酞溶液变红的溶液一定呈碱性 |
| C、单质中只含有一种元素,所以只含有一种元素的物质一定是单质 |
| D、活泼金属能与稀硫酸反应放出气体,则能与稀硫酸反应放出气体的物质一定是活泼金属 |
查看答案和解析>>
科目:初中化学 来源: 题型:
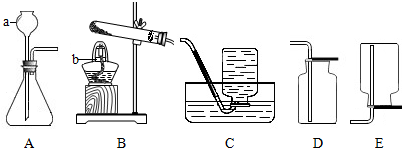
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验一 观察固体表面 | 实验二 向两块固体表面滴加稀盐酸 | 实验三 振荡3个塑料瓶 |
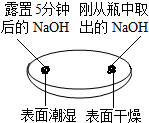 | 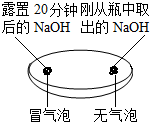 | 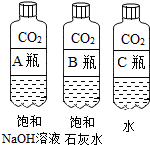 |
| 实验一 | 实验二 | 分析 |
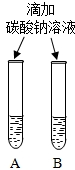 | 微热(不考虑水分蒸发)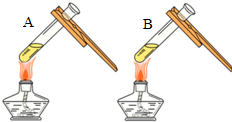 | 两种方案中均观察到A试管内出现白色浑浊,则A中溶液为 |

| 通电 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com