
| 实验操作 | 实验现象 | 实验结论 |
| 取反应后的溶液于试管中,加入 少量的碳酸钠 | 有气泡生成 | 猜想三成立 |
分析 (1)根据氢氧化钠和硫酸铜反应生成物的特点和复分解反应的条件分析回答;
(2)根据氢氧化钠和盐酸的反应及反应物的量进行分析猜想;根据盐酸能与碳酸盐等反应分析设计实验;
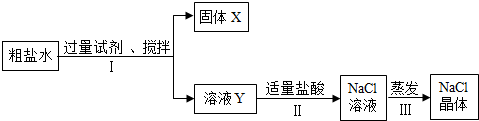
(3)①根据粗盐中含有的杂质分析加入的物质,据此分析固体X中含有的物质;
②根据加入Ba(NO3)2会引入硝酸根离子分析;
(4)根据氢氧化钠和硫酸的反应有氢氧化钠的质量求出硫酸的质量.
解答 解:(1)氢氧化钠和硫酸铜溶液能发生反应,是因为有氢氧化铜沉淀生成,符合复分解反应发生条件;
(2)【做出猜测】由于HCl和NaOH不能共存,所以,猜想猜想四不合理;
【设计实验】由于盐酸能与碳酸钠反应生成气体,所以,设计实验如下:
| 实验操作 | 实验现象 | 实验结论 |
| 取反应后的溶液于试管中,加入 少量的碳酸钠 | 有气泡生成 | 猜想三成立 |
点评 掌握氯化钠与粗盐的提纯的方法及其注意事项;掌握根据化学方程式的计算的方法;了解除杂和净化的方法,是解答本题的基础.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用灼烧的方法鉴别羊毛和涤纶 | |
| B. | 用紫色石蕊溶液鉴别CO2和CO气体 | |
| C. | 用酚酞鉴别稀盐酸和氯化钠溶液 | |
| D. | 用水鉴别硝酸铵固体和氢氧化钠固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 薯蓣皂素中含有臭氧分子(O3) | |
| B. | 它属于有机物 | |
| C. | 薯蓣皂素中碳、氢、氧元素质量比是9:14:1 | |
| D. | 若该物质在空气中燃烧,则生成物一定只有二氧化碳和水 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 无色烧碱溶液中滴入酚酞试液变为红色 | |
| B. | 白色硫酸铜粉末遇水蒸气变为蓝色晶体 | |
| C. | 银白色铝片露置在空气中表面逐渐变暗 | |
| D. | 舞台上撒上适量干冰制造出云雾缭绕的景象 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 固体 | 滤液中溶质 | |
| 可能性1 | ||
| 可能性2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com