
【题目】某研究性学习小组设计了测定纯碱(Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数的实验方案.请回答下列问题:
小资料:碱石灰的主要成分是氢氧化钠和氧化钙的混合物
(1)气体法。
【原理思路】利用Na2CO3与稀硫酸反应产生CO2,通过测量丙装置实验前后的质量得出CO2质量,从而计算碳酸钠的质量分数。(不考虑原装置内空气的影响)
【实验分析】小科同学根据以上思路,设计了如下图的实验装置。
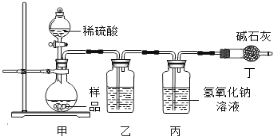
①实验装置乙中盛放的试剂为 。
装置丁中碱石灰的作用是 。(填字母)
A.吸收Na2CO3与稀硫酸反应产生CO2
B.防止外界空气中二氧化碳进入丙中
C.干燥二氧化碳
②实验中如果滴加稀硫酸的速度过快,会导致测得样品中碳酸钠的
质量分数 (填写“偏高”“偏低”或“不变”).
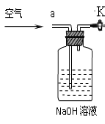
③小明同学认为小科的方案存在问题,即使操作规范下也会造成结果偏低,你认为他的理由是 ,应该将装置甲中双孔橡胶塞换成三孔橡胶塞,并增加下图装置,实验结束后缓缓通入一段时间空气,目的是 ,其中NaOH溶液的作用是 。
(2)沉淀法.
【实验原理】利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数。
【实验步骤】①用托盘天平称取样品11.0g放入烧杯中,加水使其完全溶解;
②加入过量的CaCl2溶液充分反应。证明CaCl2过量(即Na2CO3已完全反应)的方法是: 静置,向上层清液中滴加 溶液,如果没有白色沉100%=96.4%淀生成,证明CaCl2过量;
③过滤、操作X、干燥、称量沉淀的质量为10.0g,操作X的名称是 ,如果缺少此操作会造成碳酸钠质量分数 (填写“偏高”“偏低”或“不变”)。
④通过以上提供的数据计算出样品中碳酸钠的质量分数为 。(写出计算过程,结果保留至0.1%)
【答案】(1)①浓硫酸 ;B; ②偏低;③有二氧化碳残留在烧瓶中;将残留的二氧化碳全部鼓入到丙装置,使其完全被氢氧化钠吸收;吸收空气中的二氧化碳;(2)②氯化钙;③洗涤;偏高;④96.4%
【解析】
试题分析:为了测定纯碱(Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数:(1)气体法.
【实验分析】根据图1的实验装置.则可推测:①实验装置乙中盛放的试剂为浓硫酸(或浓H2SO4),其作用是吸收水蒸气(或干燥CO2);装置丁中碱石灰的作用是防止外界空气中二氧化碳进入丙中,对实验结果造成干扰.②实验中如果滴加稀硫酸的速度过快,因为碳酸根不能充分与稀硫酸反应,则会导致测得样品中碳酸钠的质量分数偏低.③如果有CO2残留在烧瓶内,也会造成结果偏低,故应该将装置甲中双孔橡胶塞换成三孔橡胶塞,并增加图2装置,实验结束后缓缓通入一段时间空气,目的是将残留的CO2全部鼓入到并装置中,使其完全被氢氧化钠溶液吸收,其中NaOH溶液的作用是吸收空气中的CO2.(2)沉淀法.【实验原理】利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数.【实验步骤】①用托盘天平称取样品11.0g放入烧杯中,加水使其完全溶解;②加入过量的CaCl2溶液充分反应.证明CaCl2过量(即Na2CO3已完全反应)的方法是:静置,向上层清液中滴加CaCl2溶液,如果没有白色沉淀生成,证明CaCl2过量;③过滤、洗涤、干燥、称量沉淀的质量为10.0g,如果缺少洗涤会造成碳酸钠质量分数偏高.
④设样品中碳酸钠的质量为x
Na2CO3+CaCl2==CaCO3↓+2NaCl
100
X 10.0g
106:100=X:10.0g
X=10.6g
碳酸钠的质量分数为10.6g/11.0g×100%=96.4%


科目:初中化学 来源: 题型:
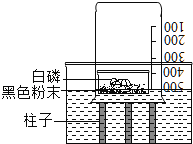
【题目】在按书本装置测定空气中氧气含量的实验时,当装置内的氧气低于一定含量时,红磷就不再与氧气反应,从而导致测量结果偏小.有老师对该实验进行了改进,装置如图所示,在一容器中倒入刚拆封的“暖宝宝”黑色粉末,再在上面放足量的白磷,迅速扣上烧杯,随后白磷自然,利用这一装置可更准确地测定空气中氧气的体积分数.
(1)黑色粉末的主要成分是什么?对此同学们做出了以下两种猜想:
猜想一:该粉末可能是木炭粉;
猜想二:该粉末可能是铁粉.
根据学过的科学知识,有同学认为猜想一肯定是错误的,你认为他的理由是
(2)通过实验证明加入的黑色粉末是铁粉.加入铁粉后使测定结果更加准确,原因是
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分) 有资料表明,氧化铜代替二氧化锰加入氯酸钾中也能很快产生氧气.先将2.4g 氧化铜与wg氯酸钾的混合物充分加热,使其不再产生气体后,残余固体经冷却、称量,质量为wg.然后将固体溶于21.3g水中,充分搅拌,过滤,得到滤液和黑色的滤渣.滤渣又经洗涤、烘干、称量,质量为2.4g。(注:不考虑每步实验过程中物质的损失;计算结果保留1位小数)
(1)该反应中氧化铜起 作用。
(2)求生成的O2质量;
(3)求所得的滤液溶质的质量分数.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(9分)下图是实验室常用的实验仪器与装置,根据所学知识回答下列问题:
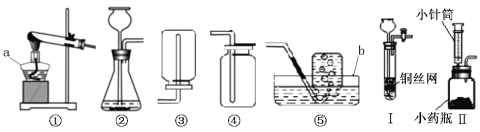
(1)写出图中编号仪器名称:a 、b ;
(2)用高锰酸钾制取氧气时,反应的化学方程式为 ,所选用的收集装置是 (填装置序号);
(3)实验室用锌粒和稀硫酸反应制取氢气,则①~⑤选用的发生装置为 (填装置序号);
(4)小波同学将装置②进行了改进,如图Ⅰ和Ⅱ。改进后的装置与装置②相比,装置Ⅰ的优点
是 ,装置Ⅱ的优点是 ;
(5)实验室若用装置Ⅰ制取二氧化碳,铜网上常放置的药品应为 (填名称),其反应的化学方程式为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(9分)某面包膨松剂由碳酸氢钠和碳酸氢铵两种物质组成。化学小组为验证该膨松剂的成分及各成分含量的测定,通过查阅资料,设计如图所示实验。

查阅资料:①膨松剂在面包制作过程中发生的两个化学反应的方程式分别是:
2NaHCO3 △ Na2CO3+H2O+CO2↑
NH4HCO3 △ NH3↑+H2O+CO2↑
②通常状况下,1体积水溶解700体积氨气,氨气溶于水所得溶液为氨水
③二氧化碳溶于水,溶液呈酸性
实验定性验证:
操 作 步 骤 | 实 验 现 象 | 实 验 结 论 |
组装仪器, | ||
装入药品进行加热,打开阀 门 、关闭阀门 。 | 观察到 | 则说明有碳酸氢铵存在 |
然后打开阀门K2、关闭阀门 K1继续加热 | 最终观察到B中试管内没有气泡冒出,且____________ 。 | 则说明有碳酸氢钠存在 |
实验分析及反思:(1) 同学甲认为应将装置B中水换成澄清石灰水,才能判断样品的成分。
同学乙认为没有必要,他的理由是 。
(2) 请你分析装置C中碱石灰的作用是 。
实验数据分析及成分含量计算:
小组同学利用电子天平共同作了以下测定实验,实验数据记录如下:
称量项目 | 称量 时间 | 质量(g) |
装置A中试管质量 | 反应前 | 50.00 |
装置A中试管+样品质量 | 反应前 | 70.00 |
装置A中试管+固体质量 | 反应后 | 60.60 |
请你分析表中实验数据并计算该膨松剂中碳酸氢铵的质量分数。(写出计算的详尽过程)
解:
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)下图表示某些物质间转化关系。其中A、D是由相同元素组成的固体,且A为紫黑色,C、Z为黑色粉末,B、E、G为气体;X与F是由相同元素组成的无色液体,且X具有消毒杀菌作用;反应⑤常用来炼铁。请回答下列问题:
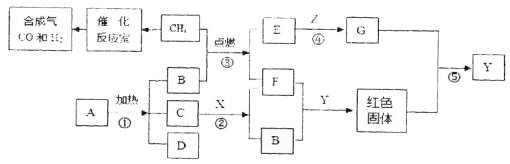
(1)A的化学式是_ ;
(2)C物质在反应2中的作用 ;
(3)写出反应②、④的化学方程式:
②_ ;④_ ;
(4)將E、G两种气体区别开来,可使用的一种溶液为_ (填名称);
(5)合成气CO和H2在一定条件下按照不同的比例可以合成不同的化工原料,达到原子利用 率最大的要求。以CO和H2合成的下列物质中,不符合要求的是_ 。
A.甲醇(CH4O) B.乙酸(C2H4O2) C.乙醇(C2H6O) D.甲醛(CH2O)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)自来水生产中通常用适量的氯气杀菌消毒,以食盐(NaCl)为原料制取氯气的流程如下图所示,根据题意填写下列空白:
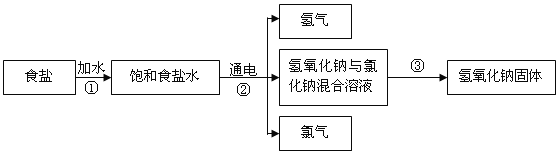
(1)上述过程中的涉及的物质属于碱的是__________(写化学式)。
(2)过程②发生反应的化学方程式为2NaCl+2X 通电 2NaOH+H2↑+Cl2↑,其中X的化学式为_________,
在反应前后Cl元素的化合价分别为_______________。
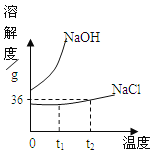
(3)氯化钠和氢氧化钠溶解度曲线如图所示,温度为t2时,过程①要将36g氯化钠配制成饱和溶液,需要水的质量为_____g;过程③要得到氢氧化钠固体所采取的结晶方法为 ____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学在实验室里制取二氧化碳和验证二氧化碳的某些性质,根据下图回答问题。

(1)写出图中仪器①的名称: 。
(2)装置甲中应添加的固体试剂的名称是 。
(3)用装置乙收集二氧化碳时,导管口a应与 (填“b”或”c” )相连。
(4)用途丙所示的质地较软的塑料瓶收集满二氧化碳,再倒入约1/3体积的紫色石蕊溶液,立即旋紧瓶盖,振荡,观察到的现象为: 。
(5)往图丁的烧杯中缓缓通入二氧化碳,超薄材料做成的内充空气的气球会慢慢浮起,由此得到二氧化碳的性质是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com