
【题目】(16分)发酵粉的主要成分中含有碳酸氢钠。某化学兴趣小组的同学对碳酸氢钠的性质进行了探究。
Ⅰ.定性探究
实验一:探究碳酸氢钠溶液的酸碱性
用pH试纸测得碳酸氢钠溶液的pH约为8,可知碳酸氢钠溶液呈 性。
实验二:探究碳酸氢钠的热稳定性
【查阅资料】碳酸氢钠受热容易分解,生成水、一种气体和一种常见的固体物质。
【实验1】取一定质量的碳酸氢钠放到铜片上加热,如图所示。
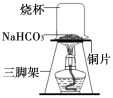
(1)加热一段时间后,观察到烧杯内壁有水珠。
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊,说明该气体是 。
(3)欲通过进一步的实验探究来确定充分加热后的固体产物的成分。
【提出假设】①可能是Na2CO3
②可能是NaOH
③可能是 。
【实验2】
实验操作 | 实验现象 | 实验结论 |
A.将该固体溶于蒸馏水配制成溶液,取少量溶液于试 管中,滴加足量稀盐酸 | 有气体产生 | 假设 (填序号)不成立 |
B.另取少量溶液于试管中,滴加 溶液 | 固体产物中有 Na2CO3 | |
C.取上述B步骤静置后所得上层清液,滴入少量 溶液 | 无明显现象 | 假设①成立 |
【实验结论】NaHCO3受热分解的化学方程式为 。
【延伸拓展】实验室有两瓶失去标签的固体药品,已知它们是碳酸钠和碳酸氢钠,你能否设计一个实验进行鉴别,请简述你的实验方案及现象和结论 。。
Ⅱ.定量探究
为测定某发酵粉中碳酸氢钠的质量分数,设计了如下实验,其主要实验步骤如下:
①按下图组装仪器,取50g样品放入锥形瓶中,关闭活塞b,打开活塞a,从导管A处缓缓鼓入一定量的空气;
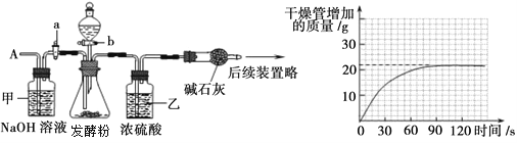
②关闭活塞a,打开活塞b,加入足量稀硫酸溶液,直至锥形瓶内不再产生气泡;
③关闭活塞b,打开活塞a,从导管A处缓缓鼓入一定量的空气;
④测量干燥管内碱石灰(氧化钙和氢氧化钠固体的混合物)增加的质量(见上图曲线);
⑤重复步骤③和④的操作,直至干燥管内物质质量不再增加。
(1)步骤①加入样品前还应 。
(2)装置甲的作用是 ,装置乙的作用是 ;
(3)请利用相关数据计算样品中碳酸氢钠的质量分数。(写出计算过程)
【答案】I、实验一:碱 【实验1】(2)CO2 【提出假设】(3)NaOH和Na2CO3
【实验2】
实验操作 | 实验现象 | 实验结论 |
② | ||
B.足量BaCl2 | 产生白色沉淀 | |
C.无色酚酞 |
【实验结论】2NaHCO3△Na2CO3+H2O+CO2↑
【延伸拓展】
方案一:取样,分别将两种样品放入试管中加热,若无明显变化的是Na2CO3,若加热后有试管壁有水珠生成,且生成气体能使澄清石灰水变浑浊,则是NaHCO3
方案二:取样,分别将两种样品放入试管中,滴入等量且等浓度的稀盐酸或稀硫酸,反应较快的是NaHCO3,反应较慢的是Na2CO3
II、(1)检查装置气密性 (2)吸收空气中的CO2 吸收水分 (3)84%
【解析】
试题分析:I、实验一:用pH试纸测得碳酸氢钠溶液的pH约为8>7,可知碳酸氢钠溶液呈碱
【实验1】(2)倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊,说明该气体是CO2
(3)根据质量守恒定律,化学反应前后,元素的种类不变,故猜想③可能是NaOH和Na2CO3
【实验2】要探究到底是那种猜想正确,应该抓住NaOH和Na2CO3的化学性质,碳酸盐能与酸反应生成二氧化碳气体,且能与钙盐或钡盐生成白色沉淀,NaOH应抓住显碱性,但同时要注意的是,但NaOH和Na2CO3一起存在的时候,由于Na2CO3溶液也显碱性,故若要通过溶液是否显碱性来判断NaOH的存在,则必须先要除去Na2CO3
实验操作 | 实验现象 | 实验结论 |
② | ||
B.足量BaCl2(合理即可) | 产生白色沉淀 | |
C.无色酚酞(合理即可) |
【实验结论】通过上面的探究可知,NaHCO3受热分解生成碳酸钠,故NaHCO3受热分解的化学方程式为:2NaHCO3△Na2CO3+H2O+CO2↑
【延伸拓展】方案一:取样,分别将两种样品放入试管中加热,若无明显变化的是Na2CO3,若加热后有试管壁有水珠生成,且生成气体能使澄清石灰水变浑浊,则是NaHCO3。
方案二:取样,分别将两种样品放入试管中,滴入等量且等浓度的稀盐酸或稀硫酸,反应较快的是NaHCO3,反应较慢的是Na2CO3
II、(1)步骤①加入样品前还应检查装置气密性,以防反应过程中产生的气体跑掉
(2)装置甲NaOH溶液的作用是:吸收空气中的CO2,以免对后面二氧化碳的质量形成干扰;装置乙的浓硫酸具有吸水性,作用是:吸收水分
(3)碱石灰干燥的作用是吸收反应生成的二氧化碳,故其质量的增加就是生成二氧化碳的质量,通过图像可看出,最终反应结束,生成二氧化碳的质量为2.2g,故可根据化学反应方程式2NaHCO3+H2SO4==Na2SO4+2H2O+2CO2↑中NaHCO3与CO2的质量关系,算出NaHCO3的质量,进一步可计算样品中碳酸氢钠的质量分数
解:设样品中碳酸氢钠的质量为x
2NaHCO3+H2SO4==Na2SO4+2H2O+2CO2↑
168 88
x 22g
168/x=88/22g
x=42g
样品中碳酸氢钠的质量分数:42g/50g×100%=84%


科目:初中化学 来源: 题型:
【题目】下列关于溶液的说法,正确的是
A. 溶液都是无色透明的 B. 面粉与水混合可形成溶液
C. 饱和溶液不能再溶解任何物质 D. 硝酸铵溶解在水中,溶液温度会降低
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示为实验室常见气体制备,净化、干燥、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器).某学校两个化学实验探究小组的同学欲用他们完成各自的探究实验.

(1)第一组的同学以石灰水和稀盐酸为原料,在实验室中制备、收集干燥纯净的二氧化碳气体,按照要求设计实验装置、连接仪器,并检验装置的气密性.(提示:挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收).
①所选仪器的连接顺序为 → → → (填写仪器序号字母).
②若将二氧化碳通入澄清的石灰水中,石灰水的pH将 (填“增大”“减小”“不变”之一).
(2)第二组的同学以过氧化氢溶液为原料(MnO2为催化剂)制备氧气,并对某种塑料的组成元素进行分析探究(资料显示该塑料只含C,H,O三种元素),所选仪器按“A→B1→E→B2→D→碱石灰干燥管”的顺序连接,(B1,B2为浓硫酸洗气瓶),实验前检验装置气密性.使该塑料试样碎屑在纯氧气中充分燃烧,观察现象,收集有关实验数据(假设发生的化学反应都充分反应),试回答下列问题:
①仪器A中所发生反应的化学方程式为: ;
②仪器E的玻璃管中放入的塑料试样碎屑质量为mg,塑料试样充分燃烧后,测得仪器D质量增加ag,则mg该塑料试样中含碳元素的质量为 g(计算结果可为分数形式).
③若装置中没有连接仪器B1,这样测算出的该塑料试样中氢元素的质量与实际值比较将 (填“偏小”“偏大”“基本一致”之一).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.C、CO和CO2都具有还原性
B.用紫色石蕊溶液可区别CO和CO2
C.金刚石、石墨都是由碳原子构成的,性质相同
D.在点燃一氧化碳气体前,可以不检验纯度
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组用一氧化碳与氧化铁的反应来探究炼铁的原理,装置如下图所示,请回答有关问题:

(1)实验进行一段时间之后,A玻璃管内观察到的现象是 。
(2)B装置中氢氧化钠溶液的作用是 。
(3)为避免将CO排放到空气中,并回收利用CO,方框中连接的是C和D装置,导管接口的连接顺序应为
a→ → →
(4)除CO外,还有氢气等物质可以还原Fe2O3,某同学设计了用金属锌粒与稀硫酸反应制取氢气的实验装置,如图所示:

①制取氢气的反应方程式为 。
②用E和F装置制取二氧化碳,F装置与E装置比较,优点是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验现象描述不正确的是
A.二氧化碳通入滴有紫色石蕊的水中,石蕊会变红
B.氢气在氧气中燃烧有淡蓝色火焰
C.电解水时负极产生的气体体积是正极气体体积的2倍
D.铁丝在空气中燃烧,火星四射,生成黑色固体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁,他们为了测定水垢中碳酸钙的含量,取某种稀盐酸100 g加入到15.8 g水垢中,产生CO2气体的情况如下图所示。计算:

(1)从图中可以看出15.8 g水垢与盐酸反应后生成CO2最多是 。
(2)水垢中碳酸钙的质量分数是多少?(计算结果保留0.1%)
(3)所用稀盐酸中溶质质量分数是多少?(计算结果保留0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列操作方法正确的是
A.用酒精灯火焰直接加热烧杯
B.打开试剂瓶取用试剂后没及时盖瓶塞
C.给试管内固体加热,试管口略向下倾斜
D.取用试剂后将滴管清洗再放回原滴瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com