
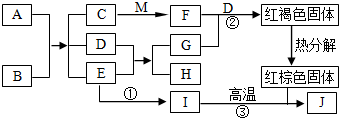
分析 根据“A是人体胃液的主要成分之一”,则推测A为稀盐酸;根据“C为浅绿色溶液”,则推测C含有亚铁离子;根据“E常用作温室肥料”,则推测E为二氧化碳;根据“J是常见金属”,则推测J为铁;根据“G是空气中的主要成分之一,H为有机物”,则推测D+E→G+H,则推测为光合作用,根据“M是一种常见的碱”,结合图框,可知M氢氧化钠,B可能为碳酸亚铁,代入检验.
解答 解:
根据“A是人体胃液的主要成分之一”,则推测A为稀盐酸;根据“C为浅绿色溶液”,则推测C含有亚铁离子;根据“E常用作温室肥料”,则推测E为二氧化碳;根据“J是常见金属”,则推测J为铁;根据“G是空气中的主要成分之一,H为有机物”,则推测D+E→G+H,则推测为光合作用,根据“M是一种常见的碱”,结合图框,可知M氢氧化钠,B可能为碳酸亚铁,代入检验.
(1)根据分析,B可能为碳酸亚铁,根据植物通过光合作用,吸收二氧化碳,生成葡萄糖和氧气,反应的化学方程式为:6CO2+6H2O$\underset{\stackrel{光照}{=}}{叶绿体}$C6H12O6+6O2.故B的化学式FeCO3; H的化学式C6H12O6.
(2)根据分析,反应①为二氧化碳生成一氧化碳,故过程中还需要加入的物质是碳.
(3)根据分析,反应②为氢氧化亚铁与氧气、水结合生成氢氧化铁,故反应的化学方程式:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
反应③为在高温条件下,一氧化碳能与氧化铁反应,生成了铁和二氧化碳,反应的方程式是:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(4)图中A与B反应为复分解反应;E生成I为化合反应;红褐色固体生成红棕色固体为分解反应;故整个图中
无置换反应;故转化没有涉及到化学反应基本反应类型中的所有类型.
故答案为:
(1)FeCO3; C6H12O6.(2)碳.
(3)4Fe(OH)2+O2+2H2O═4Fe(OH)3; Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.(4)否.
点评 本题为框图式物质推断题,完成此题,可以依据题干提供的信息,找准解题突破口,直接得出有关物质的化学式,然后顺推或逆推得出其他物质的化学式,进而完成解答即可.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:选择题
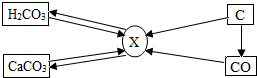 碳和碳的化合物间的部分转化关系如图所示.则下列说法正确的是( )
碳和碳的化合物间的部分转化关系如图所示.则下列说法正确的是( )| A. | 由碳酸转化成X一定要在加热条件下进行 | |
| B. | 由碳转化为X一定发生的是化合反应 | |
| C. | 物质X一定是二氧化碳 | |
| D. | 若使一氧化碳转化成X,只能通过一氧化碳在空气(或氧气)中燃烧获得 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 实验次数 | 一 | 二 | 三 | 四 | 五 | 六 |
| 加入镁粉的质量/g | 1 | 2 | 3 | 4 | 5 | 6 |
| 生成硫酸镁的质量/g | 5 | 15 | 18 | 18 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
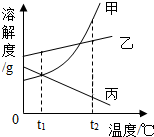 如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )| A. | t1℃时,甲、丙两种物质的溶液中溶质的质量分数一定相等 | |
| B. | 将t2℃三种物质的饱和溶液降到t1℃,析出甲的质量一定比乙多 | |
| C. | 将t2℃时三种物质的饱和溶液恒温蒸发等量水后析出溶质的质量由大到小的顺序为:丙>乙>甲 | |
| D. | 将t2℃时三种物质的饱和溶液温度降到t1℃,所得溶液中溶质的质量分数由大到小的顺序为:乙>甲>丙 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 温度/℃ | 0 | 20 | 40 | 60 | |
| 溶解度/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | |
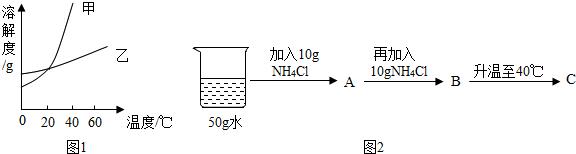
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com