
 我国古代纺织业常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白织物.
我国古代纺织业常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白织物.| 温度/℃ | 0 | 10 | 20 | 30 | 50 | |
| 溶解度/g | Ca(OH)2 | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 |
| K2CO3 | 107 | 109 | 110 | 114 | 121 | |
| KOH | 97 | 103 | 112 | 126 | 140 | |
分析 根据表格数据可以知道某温度时物质的溶解度,计算出质量分数为50%的溶液中所含溶质的质量,即可确定溶液是否饱和;根据氧化钙能与水反应放热且氢氧化钙的溶解度随温度升高而减小进行判断纵坐标的含义;根据碳酸钾与氢氧化钙的反应进行有关的计算,据此解答即可.
解答 解:(1)根据表格可以知道,20℃时,100g水中最多可溶解K2CO3的质量是110g,
溶质的质量分数为50%的KOH溶液中,设水的质量是100g,其中含溶质的质量为x,则有$\frac{x}{x+100g}$×100%=50%,解得x=100g,观察表格中氢氧化钾在不同温度下的溶解度,0℃最多溶解97g,10℃时最多溶解103g,故溶解100g氢氧化钾的溶液是不饱和溶液,故填:110;不饱和;
(2)氧化钙能与水反应放出大量的热,氢氧化钙的溶解度随温度的升高而减小,当温度升高时,氢氧化钙在水中的溶解度减小,故溶质质量逐渐减小,当温度逐渐减低时,氢氧化钙的溶解度增大,溶解的溶质逐渐增多,由于氧化钙与水反应消耗一部分水,故溶质的质量比开始时溶质质量要减小,故可以表示溶质质量的变化,溶液是由溶质和溶剂组成的,故可以表示溶液的变化,观察选项,故填:ac;
(3)设1.38g碳酸钾能生成沉淀的质量质量为x,参加反应的氢氧化钙的质量为y
K2CO3+Ca(OH)2═CaCO3↓+2KOH
138 74 100
1.38g y x
$\frac{138}{1.38g}$=$\frac{100}{x}$,解得x=1g,而实际得到了1.1g固体,说明加入的氢氧化钙的量有剩余(剩余的质量为1.1g-1g=0.1g,这0.1g氢氧化钙是0.16g溶于水之后还剩下0.1g氢氧化钙),碳酸钾全部参加反应,生成了氢氧化钾,故溶质为氢氧化钾和氢氧化钙;
$\frac{138}{1.38g}$=$\frac{74}{y}$ 解的y=0.74g,因此加入的氢氧化钙的质量为:0.74g+0.1g+0.16g=1g;
故填:氢氧化钾和氢氧化钙,1.
点评 本题考查了溶解度及化学方程式的计算的有关知识,完成此题,可以依据溶解度的有关概念进行,注意氢氧化钙的溶解度的变化.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
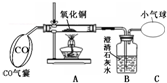 如图为一氧化碳与氧化铜反应的实验装置.请回答:
如图为一氧化碳与氧化铜反应的实验装置.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 金很活泼 | |
| B. | 金很稳定,自然界中存在金单质 | |
| C. | 金在自然界中主要以化合物形式存在 | |
| D. | 金很贵重 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com