
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 完全溶解:10.8 |
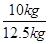 ×100%=80%
×100%=80%

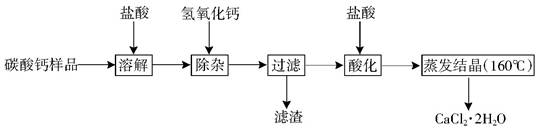
科目:初中化学 来源:不详 题型:计算题
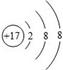

| A.该元素属于非金属元素 |
| B.该原子核内质子数为17 |
| C.该元素的原子形成阴离子后,离子结构示意图为 |
| D.该元素的相对原子质量为35.45g |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.5.85g | B.11.7g | C.14.2g | D.23.4g |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题


| 烧杯编号 | A | B | C | D | E |
| 盐酸的溶质质量分数 | 5% | 10% | 15% | 20% | 25% |
| 反应后溶液温度(℃) | 24℃ | 34℃ | 46℃ | 54℃ | 54℃ |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com