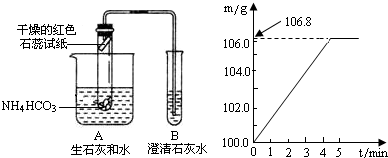
解:I、实验设计:(1)若置于试管口处的干燥的红色石蕊试纸变蓝色,根据氨气遇水呈现碱性,可判断分解生成了水和氨气;
(2)若观察到装置B试管内澄清石灰水就浑浊,说明反应放出二氧化碳气体;
(3)利用碳酸钠能与盐酸反应放出二氧化碳气体,取反应后试管B溶液滴加稀盐酸,若观察到有气体放出可说明溶液中含有碳酸钠,则证明分解放出了二氧化碳与氢氧化钠反应生成了碳酸钠;
实验结论:根据以上实验可说明,碳酸氢铵受热分解生成了水、氨气、二氧化碳,因此反应的化学方程式为:NH
4HCO
3
NH
3↑+H
2O+CO
2↑;
实验反思:由于碳酸氢铵受热能发生分解,因此保存碳酸氢铵时应放在避光的阴凉处密封保存;
II、(1)根据吸收氨气的溶液总质量m与反应时间t的变化关系图可知,完全反应后产生氨气=106.8g-100.0g=6.8g;
(2)该化肥的含氮量=

×100%=20.4%>20%,则这种化肥属于合格品;
(3)设废硫酸中纯硫酸的质量为x.
2NH
3+H
2SO
4═(NH
4)
2SO
434 98
6.8g x

=

x=

=19.6g
废硫酸中硫酸的质量分数=
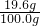
×100%=19.6%
答:废硫酸中硫酸的质量分数为19.6%;
(4)浓硫酸具有吸水性,分解产生的水被浓硫酸吸收,导致所测得氨气质量偏大;
故答案为:
Ⅰ、【实验设计】(1)干燥的红色石蕊试纸变蓝;
(2)变浑浊;
(3)
| 实验步骤 | 实验现象 | 反应的方程式 |
| 取装置B中溶液少许,滴加稀盐酸(或氯化钙或氢氧化钡溶液等) | 产生气泡
(其它对应现象) | Na2CO3+2HCl═2NaCl+CO2↑+H2O
(其它对应方程式) |
其它合理答案均可
【实验结论】NH
4HCO
3
NH
3↑+H
2O+CO
2↑;
【实验反思】避光、避热、密封等;
Ⅱ、计算:
(1)6.8g;
(2)20.4%;合格;
(3)废硫酸中硫酸的质量分数为19.6%.
(4)加热反应产生的水蒸汽被废硫酸吸收,导致所测吸收液质量比只吸收氨气大.
分析:I、实验设计:(1)分析装置图,判断装置中各部分可能出现的现象,分析得能证明分解生成氨气和水所观察到的现象;
(2)B装置试管内的澄清石灰水可以检验是否产生气体二氧化碳;
(3)若改用氢氧化钠溶液吸收,由于二氧化碳与氢氧化钠反应生成碳酸钠而无明显现象,因此,通过检验溶液中含有碳酸钠的方法,也可检验反应放出了二氧化碳;
实验结论:总结以上实验,判断碳酸氢铵分解生成的产物,写出反应的化学方程式;
实验反思:根据实验探,归纳出碳酸氢铵的性质,判断保存方法;
II、(1)根据吸收氨气的溶液总质量m与反应时间t的变化关系图,可知完全反应后溶液总质量为106.8g,与反应前100g硫酸的质量差即为所吸收氨气的质量;
(2)根据氨气的质量计算氨气中氮元素的质量,即样品中氮元素的质量,氮元素与样品的质量比可计算该化肥的含氮量,与标准比较判断是否合格;
(3)废硫酸中硫酸的质量分数=
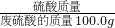
×100%,其中硫酸的质量,根据反应的化学方程式可由吸收氨气的质量计算求得;
(4)分析实验中浓硫酸可能吸收的物质,判断造成实验测得硫酸铵化肥的含氮量高于实际值的原因.
点评:本题为实验探究与化学计算的综合,难度相当大,解答时应注意读懂题意,运用基础知识逐步进行分析,切勿被过多的文字信息所困扰.

 Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4═(NH4)2SO4.
Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4═(NH4)2SO4.
 NH3↑+H2O+CO2↑;
NH3↑+H2O+CO2↑; ×100%=20.4%>20%,则这种化肥属于合格品;
×100%=20.4%>20%,则这种化肥属于合格品; =
= x=
x= =19.6g
=19.6g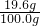 ×100%=19.6%
×100%=19.6% NH3↑+H2O+CO2↑;
NH3↑+H2O+CO2↑;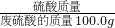 ×100%,其中硫酸的质量,根据反应的化学方程式可由吸收氨气的质量计算求得;
×100%,其中硫酸的质量,根据反应的化学方程式可由吸收氨气的质量计算求得;