
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
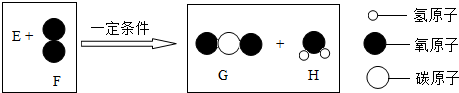
| A. | H中氢元素的质量为2克 | B. | E为含氧化合物 | ||
| C. | G和H的分子个数比为1:2 | D. | E分子中原子个数比为1:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氯仿应保存在棕色细口瓶中 | |
| B. | 用硝酸银溶液检查氯仿是否变质 | |
| C. | 用酚酞试液检查氯仿是否变质 | |
| D. | 取用氯仿做检查时应在通风橱中进行 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

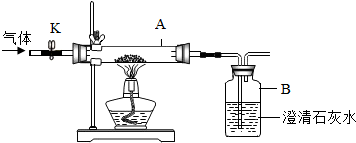
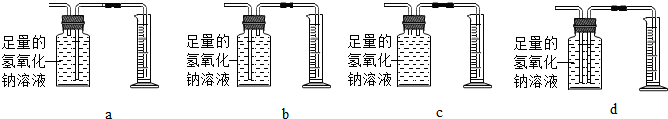
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
| ① | 1.2g | / | |
| ② | 1.2g | CuO 0.5g | |
| ③ | 1.2g | MnO2 0.5g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com