
【题目】如下图所示,某校化学兴趣小组用过氧化氢(H2O2)溶液(MnO2作催化剂) 制取干燥氧气,并用来测定 10g 某铜粉样品(含少量杂质碳)中铜的质量分数。
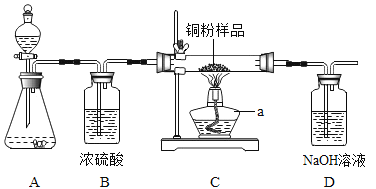
回答下列问题:(温馨提示:2Cu+O2![]() 2CuO;氢氧化钠溶液可以吸收二氧化碳)
2CuO;氢氧化钠溶液可以吸收二氧化碳)
(实验一)
(1)装置A 中发生的化学方程式是__________。装置B的作用是__________。
(2)通过称量完全反应前后装置__________的质量,进行计算便可求出样品中铜的质量分数。
(3)实验完毕,小华同学误将用剩的H2O2溶液和装置C玻璃管中的剩余固体一起倒入烧杯中,发同有大量的气泡产生,经检验确认产生的气体是氧气,小江和小田两位同学对此颇感兴趣,进而展开了他们的探究之旅。
(提出问题)
是哪种物质加快了H2O2的分解速率?
(大胆猜想)
猜想①:剩余固体中的氧化铜加快了H2O2溶液的分解。
猜想②:氧化铜能做H2O2分解的催化剂。
(实验二)
实验方案 | 实验现象 | 分析及结论 |
步骤一:将带火星的木条伸入盛有5mL5%过氧化氢溶液的试管。 | 带火星木条不复燃 | H2O2溶液常温下产生氧气的量很少,不足以使带火星复燃。 |
步骤二:向盛有 5mL5%H2O2溶液的试管中加入 1g 氧化铜固体,将一根带火星的木条伸入试管中。观察现象。待反应结束后将试管里的剩余物进行___________、洗涤、干燥、称量。对比反应前后固体的质量。 | 称得固体质量为 1g | 猜想①成立,并且反应前后固体的质量相等。 |
(讨论交流)
小川同学认为,根据步骤一、二的实验现象,得出的两个结论就能判断猜想②成立。你是否支持他的观点?___________。若要证明猜想②成立,你认为还应补做的实验是___________。
(4)该化学兴趣小组利用压强传感器,对MnO2、CuO、Fe2O3三种金属氧化物中,哪一个更适宜作过氧化氢制取氧气的催化剂,又做了如下数字化实验探究。
(实验三)实验方法如下:
Ⅰ.用MnO2、CuO、Fe2O3三种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
Ⅱ.取30粒含MnO2的海藻酸钠微球,采用如下图所示装置进行实验。改用其他两种微球,分别重复上述实验,得到的锥形瓶内压强随时间变化的曲线如下图所示。
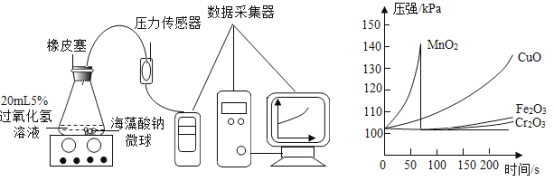
①每次重复实验时,海藻酸钠微球数应相同的原因是_________________________________。
②用含MnO2的海藻酸钠微球进行实验,60s 时压强瞬间回落,其原因可能是____________________。
③从实验曲线看,催化效果较好,反应温和的催化剂是______________________。
【答案】2H2O2![]() 2H2O+O2↑ 干燥O2 C 过滤 带火星的木条复燃 取过滤、洗涤、干燥、称重后的1g固体置于5mL5%2H2O2溶液中,深入带火星的小木条检验 控制变量 产生气体速率太快,使瓶内压强过大,把橡皮塞崩开 CuO
2H2O+O2↑ 干燥O2 C 过滤 带火星的木条复燃 取过滤、洗涤、干燥、称重后的1g固体置于5mL5%2H2O2溶液中,深入带火星的小木条检验 控制变量 产生气体速率太快,使瓶内压强过大,把橡皮塞崩开 CuO
【解析】
[实验一](1)过氧化氢在二氧化锰作催化剂的条件下能反应生成水和氧气,发生的化学方程式是2H2O2![]() 2H2O+O2↑;浓硫酸具有吸水性,能干燥氧气;
2H2O+O2↑;浓硫酸具有吸水性,能干燥氧气;
(2)铜与氧气反应生成氧化铜,碳与氧气反应生成二氧化碳,因此无法通过装置C的质量变化进行计算,但碳反应生成的二氧化碳被氢氧化钠吸收,因此可通过称量装置D反应前后的质量差求出二氧化碳的质量,从而求出碳的质量,进一步算出铜的质量分数;
[实验二]步骤一将带火星的木条伸入盛有5mL,5%H2O2溶液的试管,观察到带火星木条不复燃,这说明H2O2溶液常温下产生氧气的量少,不足以使带火星木条不复燃;
步骤二:向盛有5mL 5%H2O2溶液的试管中加入1g氧化铜固体,将一根带火星的木条伸入试管,观察到带火星的木条复燃,待反应结束后将试管的剩余物进行过滤,洗涤、干燥、称量。对比反应前后固体的质量,称得固体质量为1g,这说明猜想①成立,并且反应前后固体的质量相等;
若要证明猜想②成立,还应补做的实验是验证化学反应前后,氧化铜的化学性质没有改变,即将过滤出来的1g氧化铜放入盛有5mL 5%H2O2溶液的试管中,观察是否还会产生能使带火星的木条复燃的气体;
[实验三]①每次实验时,海藻酸钠微球数应相同是为了确保催化剂用量一致;
②用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,可能是因为产生气体的速率过快,导致气压过大,橡皮塞被弹出;
③从实验曲线看,二氧化锰太剧烈,氧化铁和三氧化二铬太慢,故催化效果较好、反应温和的催化剂是CuO。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:初中化学 来源: 题型:
【题目】水是生命之源,也是工农业生产不可缺少的物质。合理利用和保护水资源是我们义不容辞的责任。
(1)下列做法不合理的是______(填序号)。
①严格监管化肥和农药的使用 ②积极探索污水处理的新技术 ③不间断地放水洗衣服
(2)利用如图所示的简易装置可把海水转化为淡水。下列说法错误的是_______(填序号)。
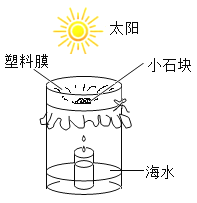
a.小容器中的水为淡水
b.大容器中得到的溶液一定是氯化钠的饱和溶液
c.获得淡水的快慢与温度有关
(3)市售“自热米饭”的自加热原理:饭盒夹层中的水与生石灰接触,反应放出大量热。该反应的化学方程式为_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D中都含有地壳中含量最多的元素,它们之间的关系如图所示,一表示物质间可以相互反应,→表示一种物质可以转化成另一种物质。B可用于光合作用,A→D放热反应。
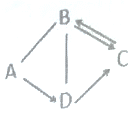
(1)B在生活中的用途是______。
(2)C的化学式为________。
(3)A→D反应的化学方程式是_______,基本反应类型是______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】大型电动车使用的磷酸亚铁理(LiFePO4)电池,具有“体积小、成本低、充电快、输出功率高、循环寿命长”等优点。下列关于LiFePO4说法不正确的是( )
A. LiFePO4的相对分子质量为158
B. LiFePO4中锂、磷元素的质量比为7:31
C. LiFePO4中的非金属元素的原子个数比为2:5
D. LiFePO4中铁元素的质量分数表示为![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类一直在探索宇宙的奥秘。月球的月壳中主要含有:U(铀)、Th(钍)、K、0、Si、Mg、Fe、Ti(钛)、Ca、Al、H、He-3等元素,未来可能会成为人类的宝贵资源。根据图示回答下列问题:
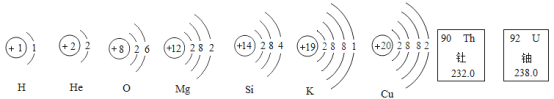
(1)铀元素的原子序数为_________________;钍的元素符号是___________。H元素和He元素的本质区別是___________不同。
(2)根据结构示意图判断,钙元素位于元素周期表中第___________周期___________族。
(3)画出铝原子的结构示意图是__________;在化学反应中铝原子容易失去电子形成__________(用离子符号表示);与硝酸根离子结合形成的化合物的化学式为___________,该物质的名称读作__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铜锈,俗称“铜绿”,主要成分是Cu2(OH)2CO3。课外活动小组围绕铜生锈的条件展开探究:
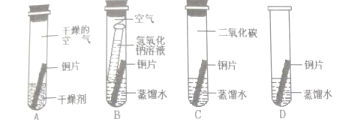

(查阅资料)二氧化碳易与氢氧化钠溶液发生化学反应,生成碳酸钠和水。
提出问题)铜在什么条件下会生锈?
(假设猜想)根据铜锈主要成分的化学式,猜想铜生锈可能是铜与空气中水、氧气、_______共同作用的结果。
(探究过程)小组同学设计了“铜片锈蚀条件的探究”实验如上图所示:实验进行较长一段时间后,观察现象可发现_______(填序号)试管中的光亮铜片最先生锈。B试管中氢氧化钠溶液的作用____________。
(评价与改进)我认为课外小组设计的实验不够完普,若要得出正确结论,还要补充的一个实验是(也可在上面方框内画图表示)_____________
(反思与小结)补充实验后,通过实验证明了原猜想正确,则铜生锈变成铜绿的化学方程式为______
(拓展应用)写出一种防止铁或铜等金属制品生锈的具体方法为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小红对铁的锈蚀进行如下探究:室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图。观察到量筒内的水沿导管慢慢进入广口瓶(净容积为146mL)。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录量筒起始读数和最终读数以及所需时间如下表。
序号 | 样品组成 | 量筒起始读数/mL | 量筒最终读数/mL | 所需时间/min |
① | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
② | 1g铁粉、0.2g碳、10滴水和少量NaCl | 100 | 70 | 约70 |
③ | _______ |
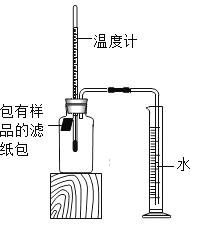
(1)实验①和②说明NaCl可以_________(填“加快”或“减慢”)铁锈蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是_________(填“放热”或“吸热”)过程。
(3)实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成。
(4)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是__________(精确到0.1)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某工厂排放的工业废水中含有硫酸亚铁和少量硫酸铜。下图是从该废水中回收金属铜和硫酸亚铁晶体的主要流程,请回答下列问题:
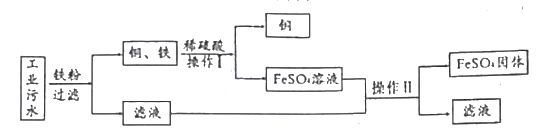
(1)工业废水中加入铁粉后发生反应的化学方程式为________。
(2)操作I名称为_______;玻璃棒在该操作中的用途为________。
(3)进行操作I前加入稀硫酸的目的是__________ ,能否用稀盐酸代替?(填“能”或“不能”),原因是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】中国科学院某研究小组设计了一种高性能锂空气电池,其反应原理可表示为:Li+O2![]() Li2O2,已知锂元素在化合物中显+1价,下列说法错误的是
Li2O2,已知锂元素在化合物中显+1价,下列说法错误的是
A. 反应物锂是金属单质
B. 该反应中MnO2是催化剂
C. Li2O2中氧元素的化合价显-2价
D. 该反应是化合反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com