
| 65 |
| x |
| 161 |
| y |
| 2 |
| 0.2g |
| 20g-6.5g |
| 20g |
| 16.1g |
| 6.5g+100g-0.2g |


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:初中化学 来源: 题型:
 (2012?济宁)我市东部山区盛产石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:
(2012?济宁)我市东部山区盛产石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:查看答案和解析>>
科目:初中化学 来源: 题型:
| 方案 | 实验方法和步骤 | 实验现象 | 实验结论 | 老师评价 |
| Ⅰ | (1)无色溶液中加BaCl2;(2)白色沉淀中加稀HNO3 | 产生白色沉淀;沉淀不溶解 | 存在SO42- | 不合理 |
| Ⅱ | (1)无色溶液中加Ba(NO3)2;(2)白色沉淀中加稀H2SO4 | 产生白色沉淀;仍有大量白色沉淀 | 存在SO42- | 不合理 |
| 你认为 | 方案Ⅰ不合理的理由是,若溶液中有 Ag+ Ag+ 同样有上述现象. | |||
| 方案Ⅱ不合理的理由是,若溶液中有 CO32- CO32- 同样有上述现象. | ||||
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
| 方案 | 实验方法和步骤 | 实验现象 | 实验结论 | 老师评价 |
| Ⅰ | (1)无色溶液中加BaCl2;(2)白色沉淀中加稀HNO3 | 产生白色沉淀;沉淀不溶解 | 存在SO42- | 不合理 |
| Ⅱ | (1)无色溶液中加Ba(NO3)2;(2)白色沉淀中加稀H2SO4 | 产生白色沉淀;仍有大量白色沉淀 | 存在SO42- | 不合理 |
| 你认为 | 方案Ⅰ不合理的理由是,若溶液中有______同样有上述现象. | |||
| 方案Ⅱ不合理的理由是,若溶液中有______同样有上述现象. | ||||
查看答案和解析>>
科目:初中化学 来源: 题型:
我市东部山区盛产 石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:
石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:
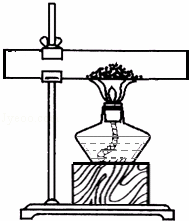
方案一:取10g石灰石粉末样品置于右图所示装置,充分加热至质量恒定,冷却后称得固体质量为8.12g.
方案二:另取10g同质地石灰石颗粒样品,置于烧杯中加足量稀盐酸,充分反应后称得混合物的总质量减少了4.27g.
相关资料:
当地石灰石含有的主要杂质为二氧化硅,其化学性质稳定,加热不易分解且不与盐酸发 生化学反应.
生化学反应.
计算出两种方案测得的石灰石中碳酸钙的质量分数:
(1)方案一中碳酸钙的质量分数是 ;
(2)方案二中碳酸钙的质量分数是 .(精确到0.1%)
比较两方案测量的结果,分析两方案误差较大的可能原因?
.
查看答案和解析>>
科目:初中化学 来源:2004年湖北省黄冈市黄州中学中考化学模拟试卷(解析版) 题型:填空题
| 方案 | 实验方法和步骤 | 实验现象 | 实验结论 | 老师评价 |
| Ⅰ | (1)无色溶液中加BaCl2;(2)白色沉淀中加稀HNO3 | 产生白色沉淀;沉淀不溶解 | 存在SO42- | 不合理 |
| Ⅱ | (1)无色溶液中加Ba(NO3)2;(2)白色沉淀中加稀H2SO4 | 产生白色沉淀;仍有大量白色沉淀 | 存在SO42- | 不合理 |
| 你认为 | 方案Ⅰ不合理的理由是,若溶液中有 同样有上述现象. | |||
| 方案Ⅱ不合理的理由是,若溶液中有 同样有上述现象. | ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com