
下列实验中,实验方案及现象与结论不一致的是
| 实验方案及现象 | 实验结论 | |
| A | ①铜丝插入硫酸锌溶液,一段时间后,无明显现象 ②铜丝插入硝酸银溶液,一段时间后,铜丝上有银白色金属析出 | 金属活动性:锌>铜>银 |
| B | ①加热KClO3制O2速度慢 ②加热KClO3和KMnO4混合物制O2速度快 | KMnO4是KClO3制取O2的催化剂 |
| C | 碳酸钙受热发生分解反应,检验到有CO2生成 | 碳酸钙中一定含有碳元素和氧元素 |
| D | ①向盛有蒸馏水的试管中加入一根铁钉(铁钉一半露置在空气中),一段时间后,铁钉生锈 ②将铁钉浸没在经煮沸并迅速冷却蒸馏水中,再加入 2 mL植物油,一段时间后,铁钉未生锈 | 与氧气接触是铁钉生锈的条件之一 |
科目:初中化学 来源: 题型:阅读理解
 21、一年的化学学习,我们亲身体验了一系列的探究实验,感受到了化学的无穷魅力.小强在回顾整理下列实验中提炼了许多探究方法:
21、一年的化学学习,我们亲身体验了一系列的探究实验,感受到了化学的无穷魅力.小强在回顾整理下列实验中提炼了许多探究方法:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验操作 | 实验现象 | 实验结论 |
| ①从甲同学的烧杯中取少量上层清液于试管中,向其中滴加足量 CaCl2 CaCl2 溶液. |
有白色沉淀生成 |
生成白色沉淀的化学方程式为: Na2CO3+CaCl2=CaCO3↓+2NaCl Na2CO3+CaCl2=CaCO3↓+2NaCl . |
| ②过滤,向滤液中滴加无色酚酞试液. | 无明显现象 | 通过实验及分析,样品中不含有: Ca(OH)2、NaOH和CaO Ca(OH)2、NaOH和CaO . |
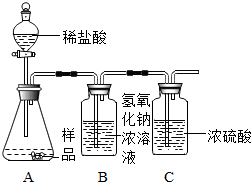
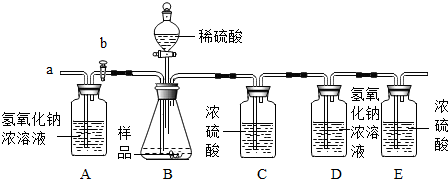
查看答案和解析>>
科目:初中化学 来源: 题型:
(2013?海淀区二模)下列实验中,实验方案与结论的对应关系正确的是( )
|
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 如图是某同学设计的探究空气中氧气含量的实验装置,请你协助他共同完成下列实验相关的内容.
如图是某同学设计的探究空气中氧气含量的实验装置,请你协助他共同完成下列实验相关的内容.
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
下列实验中,实验方案及现象与结论不一致的是( )
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com