
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 加入稀盐酸质量(g) | 10 | 10 | 10 | 10 |
| 剩余固体的质量(g) | 9.10 | 8.45 | 7.80 | 7.80 |
分析 (1)根据金属活动性可知,铜不能与稀盐酸发生反应,锌与盐酸反应生成氯化锌同时放出氢气;
(2)第二次加入10g盐酸,导致固体由9.10g变成了8.45g,第三次也是有8.45g变成7.80g,说明每加入10g盐酸能够使固体减少0.65g.所以第二次加入盐酸消耗锌的质量=9.10g-8.45g=0.65g,根据反应的化学方程式,可列出计算生成氢气的比例式;
(3)由第四次实验数据可知,剩余的7.80g固体即为样品中铜的质量,铜的质量与样品质量比可计算出黄铜样品中铜的质量分数,而样品的质量=9.10g+0.65g=9.75g.
解答 解:(1)锌在金属活动顺序表中位于氢之前能把盐酸中的氢置换出来,反应的化学方程式为Zn+2HCl═ZnCl2+H2↑;反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的化学反应,属于置换反应.
故答案为:Zn+2HCl═ZnCl2+H2↑;
(2)第二次加入10g盐酸,导致固体由9.10g变成了8.45g,第三次也是有8.45g变成7.80g,说明每加入10g盐酸能够使固体减少0.65g.所以第二次加入盐酸消耗锌的质量=9.10g-8.45g=0.65g,则有:
Zn+2HCl═ZnCl2+H2↑
65 2
0.65g x
$\frac{65}{0.65g}$=$\frac{2}{x}$
故答案为:
(3)由第二次实验可知,第一次加入10g稀盐酸时,反应消耗锌的质量为0.65g,则原黄铜样品的质量=9.10g+0.65g=9.75g;由第四次实验可知,样品中铜的质量7.80g
黄铜样品中铜的质量分数=$\frac{7.80g}{9.75g}$×100%=80%
故答案为:(1)Zn+2HCl═ZnCl2+H2↑;置换;(2)$\frac{65}{0.65g}$=$\frac{2}{x}$(3)80%.
点评 分析每次加入10g稀盐酸固体剩余物质量的变化,可对反应进行的情况进行判断,这是解决本题的基础.


科目:初中化学 来源:【全国市业模拟考试(一)化学试卷 题型:信息分析题
根据下列三个化学反应回答问题:
A.2KOH+SO3 = K2SO4+H2O; B.2HClO = 2HCl+O2↑; C.H2CO3 = H2O+CO2↑
(1)如图是某化学反应的示意图, 其中“ ”、“
”、“ ”和“
”和“ ”分别表示三种原子。上述三个反应中与其相符的是__________(填序号)。
”分别表示三种原子。上述三个反应中与其相符的是__________(填序号)。
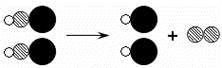
(2)分类研究是学习化学的一种常用的方法,上述三个反应中涉及到多种类别的物质,其中属于单质的是___________,属于碱的是___________,属于盐的是___________(均填化学式)。
(3)从A、B两个反应涉及到的物质中选择适当的物质,写出一个属于中和反应的化学方程式_____________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 不应该用钢丝球洗刷铝制炊具 | |
| B. | 食品袋里充入氮气延长食品的保质期 | |
| C. | 厨房中天然气泄露,立即关闭气阀,打开门窗 | |
| D. | 用锡制灯丝 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 2010年10月1日,嫦娥二号成功升空,2010年8月26日蛟龙号深海载人潜水器成功下水,上天和入海,实现了中国人心中探索自然的两大夙愿.
2010年10月1日,嫦娥二号成功升空,2010年8月26日蛟龙号深海载人潜水器成功下水,上天和入海,实现了中国人心中探索自然的两大夙愿.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 骑自行车出行 | B. | 开展植树造林 | ||
| C. | 工厂废气直接排放 | D. | 提倡使用新能源 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com