
ij������ȤС���һ������Ʒ���������ʣ����ʲ�����ˮ��Ҳ����ϡ���ᷴӦ�����з�
�����ס��ҡ�����λͬѧ�ֱ����ʵ�飬����ֻ��һλͬѧ��ȡ�õ�ϡ����������Ʒǡ����ȫ��Ӧ��ʵ���������±����ձ�������Ϊ44.1g����
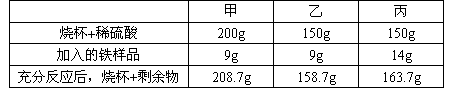
��������������ݣ��ش��������⣺
��1�� ͬѧ��ȡ�õ�ϡ����������Ʒǡ����ȫ��Ӧ��
��2��������Ʒ������������������������ȷ��0.1%����ͬ����
��3������ǡ����ȫ��Ӧ��������Һ�����ʵ�����������
�⣺
��1���� ���������������� 1��
��2������Ʒ����������Ϊx
Fe + H2SO4 = FeSO4 + H2��
56 2 ���������������� 2��
x 159g-158.7g=0.3g
56/x = 2/0.3g x = 8.4g ���������������� 1��
��Ʒ��������������= 8.4g / 9g ��100% = 93.3%���������������� 1��
����Ʒ��������������Ϊ93.3% ��
��3���跴Ӧ������������������Ϊy
Fe + H2SO4 = FeSO4 + H2�� ���������������� 2��
152 2
y 0.3g
152/y = 2/0.3g y=22.8g ���������������� 1��
��Ӧ��������Һ�����ʵ���������=22.8g/(158.7g-44.1-0.6) ��100% = 20.0% �� 2��
�𣺷�Ӧ��������Һ�����ʵ���������Ϊ20.0% ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | �� | �� | |
| ϡ�����������g�� | 200 | 300 | 200 |
| ���������Ʒ��������g�� | 12 | 12 | 20 |
| ��ַ�Ӧ�����������������g�� | 0.4 | 0.4 | 0.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | �� | �� | |
| �ձ�+ϡ���� | 250g | 200g | 200g |
| ���������Ʒ | 9g | 9g | 14g |
| ��ַ�Ӧ���ձ�+ʣ���� | 258.7g | 208.7g | 213.7g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | �� | �� | |
| �ձ�+ϡ���� | 200g | 150g | 150g |
| ���������Ʒ | 9g | 9g | 14g |
| ��ַ�Ӧ�� �ձ�+ʣ���� |
208.7g | 158.7g | 163.7g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | �� | �� | |
| �ձ�+ϡ���� | 250g | 200g | 200g |
| ���������Ʒ | 9g | 9g | 14g |
| ��ַ�Ӧ���ձ�+ʣ���� | 258.7g | 208.7g | 213.7g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | �� | �� | |
| �ձ�+ϡ���� | 150g | 200g | 150g |
| ���������Ʒ | 9g | 9g | 12g |
| ��ַ�Ӧ���ձ�ʮʣ���� | 158.7g | 208.7g | 161.7g |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com