
| 碱 | 酸 | 盐 | 非金属氧化物 | |
| A | 纯碱 | HNO3 | 胆矾 | SO2 |
| B | 烧碱 | H2SO4 | NaCl | CO |
| C | 苛性钠 | HCl | 石灰石 | NO2 |
| D | 熟石灰 | H2CO3 | 苏打 | MnO2 |
| A. | A | B. | B | C. | C | D. | D |
科目:初中化学 来源: 题型:选择题
| A. | 水在4℃时的密度为1g/cm3 | B. | 在降低温度的情况下,水能结成冰 | ||
| C. | 水在101KPa时的沸点为100℃ | D. | 水在通电条件下能分解 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
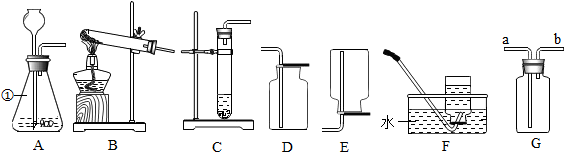
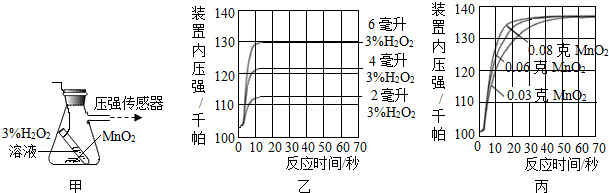
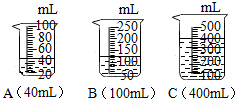
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
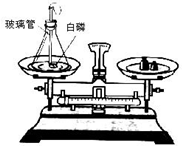 某班同学在做测定红磷燃烧前后质量变化情况的实验,实验装置如图.
某班同学在做测定红磷燃烧前后质量变化情况的实验,实验装置如图.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 元素 | Na | Mg | ① | Si | P | ② | Cl |
| 原子的最外层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 原子半径(10-10m) | 1.86 | 1.60 | 1.43 | ③ | 1.10 | 1.02 | 0.994 |
| 最高正价 最低负价 | +1 | +2 | ④ | +4 -4 | +5 -3 | ⑤ | +7 -1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com