

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  等质量的Zn、Mg分别与足量稀盐酸反应 | |
| B. |  将铁皮放入硫酸铜溶液中 | |
| C. |  电解水生成两种气体 | |
| D. | 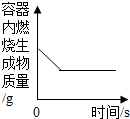 在密闭容器中,甲烷完全燃烧 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
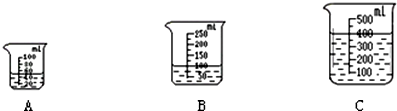
 溶解度曲线为我们定量描述物质的溶解性强弱提供了便利.请你根据图的溶解度曲线
溶解度曲线为我们定量描述物质的溶解性强弱提供了便利.请你根据图的溶解度曲线| A. | 甲物质的溶解度大于乙物质的溶解度 | |
| B. | 40℃时,两种物质溶液的质量分数相同 | |
| C. | 60℃时,将60g乙物质放入100g水中,所得溶液的质量为160g | |
| D. | 甲中混有少量的乙,可以采用降温结晶的方法提纯甲 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 选项 | A | B | C | D |  |
现象放大图 |  |  |  |  |

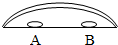 所示装置来研究微粒的性质,过程如下:
所示装置来研究微粒的性质,过程如下:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 有少量气泡 木条不复燃 | 常温下过氧化氢溶液分解速率很慢. |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 产生大量的气泡 木条复燃 | Al2O3能加快过氧化氢的分解速率 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①④③②⑤ | B. | ①③④②⑤ | C. | ④⑤③①② | D. | ④③⑤①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com