
 =85mL;配制溶液用到的仪器有:烧杯、玻璃棒、量筒、胶头滴管、天平、药匙.所以玻璃仪器是:烧杯、玻璃棒、量筒;
=85mL;配制溶液用到的仪器有:烧杯、玻璃棒、量筒、胶头滴管、天平、药匙.所以玻璃仪器是:烧杯、玻璃棒、量筒;

科目:初中化学 来源: 题型:阅读理解

| 实验方案 | 实现现象 | 结论 |
| ①取一定量的合金粉末,加过量的 30%NaOH溶液 30%NaOH溶液 ,充分反应后过滤,滤渣备用. |
粉末部分溶解,并有气体放出. | 合金中一定含有 铝 铝 . |
| ②取步骤①所得滤渣,加过量的 10%盐酸 10%盐酸 ,充分反应. |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 铁和铜 铁和铜 . |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论 |
| 取袋内固体与一定量的水混合后于烧杯中,充分搅拌后过滤,向滤液中 通入二氧化碳 通入二氧化碳 . |
溶液变浑浊 溶液变浑浊 |
猜想2正确 |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:
硫化氢( H2S) 是一种没有颜色,具有臭鸡蛋气味的有毒气体,其密度比空气大,且能溶于水形成氢硫酸,在空气中点燃硫化氢气体有SO2和水生成。实验室通常用块状固体硫化亚铁(FeS)与稀硫酸混合,在常温下发生复分解反应,制得硫化氢气体,试回答:
H2S) 是一种没有颜色,具有臭鸡蛋气味的有毒气体,其密度比空气大,且能溶于水形成氢硫酸,在空气中点燃硫化氢气体有SO2和水生成。实验室通常用块状固体硫化亚铁(FeS)与稀硫酸混合,在常温下发生复分解反应,制得硫化氢气体,试回答:

(1)写出硫化氢在空气中燃烧的化学方程式 。
(2)根据装置图回答下列问题:
①制取H2S气体的发生装置 可选用 。
②若用C装置收集H2S气体,进气口应为 。
③为了验证硫化氢的水溶液呈酸性,可将气体通入装置D,则D中所盛的试剂应该是 。
④做上述实验时,为了防止多余的H2S气体逸出污染环境,可将其通入装置E吸收。E中试剂为 。
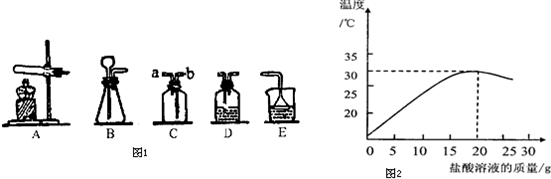
(3)某化学兴趣小组的同学在实验室配制溶质质量分数为7.3%的稀盐酸,并用其测定某氢氧化钠溶液溶质的质量分数。右图表示用上述配制的稀盐酸与40 g某氢氧化钠溶液发生反应过程中,使用数字传感仪测得溶液温度变化的曲线。
①该图像说明中和反应 ,(放热或吸热)
②当加入25 g盐酸溶液时,所得溶液中的微粒有:
(用化学符号表示)。
③试某氢氧化钠溶液的溶质质量分数。
 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com