
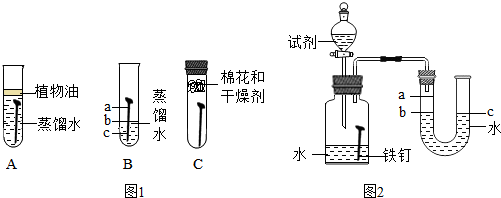
| 影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
| ①温度 | 装置Ⅰ放入25℃恒温环境中,装置Ⅱ放入40℃恒温环境中 | 两套装置中铁钉均锈蚀,且U形管中液面均由b处上升至a处,则所需时间:Ⅰ>Ⅱ | 锈蚀的速率:Ⅰ<Ⅱ; 铁的锈蚀速率与反应时的温度有关,温度越高,铁的锈蚀速率越快 |
| ②氧气含量 | 在相同温度下,向Ⅰ、Ⅱ两套装置中分别通入氧气和空气 | 铁钉均锈蚀,且U形管中液面由b处上升至a处,所需时间:Ⅰ<Ⅱ | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快 |
| ③水溶液的 导电性 | 在相同温度下,装置I集气瓶中加入10mL氯化钠溶液:装置Ⅱ集气瓶中加入10mL乙醇 | 两套装置中铁钉均锈蚀;且U形管中液面均由b处上升至a处,则所需时间:Ⅰ<Ⅱ | 铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,锈蚀的速率加快 |
分析 铁与水和氧气同时接触时容易生锈,生锈的速率与温度、氧气的浓度和溶液能否导电有关;
金属腐蚀包括吸氧腐蚀和析氢腐蚀等.
解答 解:Ⅰ.在铁画表面镀金的主要作用是防止铁制品被腐蚀.
故填:防止腐蚀.
Ⅱ.(1)①通过实验发现:铁锈蚀是铁与水和氧气发生化学反应的过程;
②A中加入的蒸馏水要事先煮沸,其目的是将溶解在水中的氧气赶出.
故填:水和氧气;将溶解在水中的氧气赶出.
(2)实验过程如下表所示:
| 影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
| ①温度 | 装置Ⅰ放入25℃恒温环境中,装置Ⅱ放入40℃恒温环境中 | 两套装置中铁钉均锈蚀,且U形管中液面均由b处上升至a处,则所需时间:Ⅰ>Ⅱ | 锈蚀的速率:Ⅰ<Ⅱ; 铁的锈蚀速率与反应时的温度有关,温度越高,铁的锈蚀速率越快 |
| ②氧气含量 | 在相同温度下,向Ⅰ、Ⅱ两套装置中分别通入氧气和空气 | 铁钉均锈蚀,且U形管中液面由b处上升至a处,所需时间:Ⅰ<Ⅱ | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快 |
| ③水溶液的 导电性 | 在相同温度下,装置I集气瓶中加入10mL氯化钠溶液:装置Ⅱ集气瓶中加入10mL乙醇 | 两套装置中铁钉均锈蚀;且U形管中液面均由b处上升至a处,则所需时间:Ⅰ<Ⅱ | 铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,锈蚀的速率加快 |
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:解答题
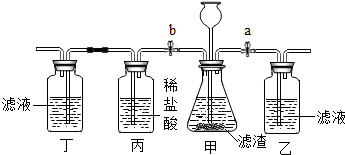 松花蛋又名皮蛋,是老百姓喜爱的食品.某化学实验小组将制作皮蛋的原料:生石灰、纯碱和食盐放入足量水中,充分反应后过滤,得到澄清溶液和滤渣:(已知:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH)
松花蛋又名皮蛋,是老百姓喜爱的食品.某化学实验小组将制作皮蛋的原料:生石灰、纯碱和食盐放入足量水中,充分反应后过滤,得到澄清溶液和滤渣:(已知:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH)查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 红磷 一氧化碳 空气 | B. | 生铁 碳酸钙 矿泉水 | ||
| C. | 氢气 乙醇 石油 | D. | 氦气 葡萄糖 冰水共存物 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
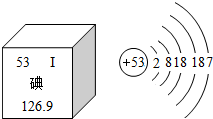 美国科学家罗伯特•莱夫科维茨和布莱恩•科比尔卡因进一步揭示了G蛋白偶联受体的内在工作机制,分享了当年的诺贝尔化学奖.莱夫科维茨从1968年便开始利用放射性碘来寻找细胞接受信号的物质,这种物质后来被称为“G蛋白偶联受体”.如图是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图.下列说法错误的是( )
美国科学家罗伯特•莱夫科维茨和布莱恩•科比尔卡因进一步揭示了G蛋白偶联受体的内在工作机制,分享了当年的诺贝尔化学奖.莱夫科维茨从1968年便开始利用放射性碘来寻找细胞接受信号的物质,这种物质后来被称为“G蛋白偶联受体”.如图是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图.下列说法错误的是( )| A. | 碘的相对原子质量为126.9,原子核内质子数为53 | |
| B. | 碘原子核外共有53个电子,最外层有7个电子 | |
| C. | 碘元素属于非金属元素,碘原子在化学反应中容易得到电子 | |
| D. | 碘盐中含有碘酸钾(KIO3),KIO3中K、I、O的质量比为1:1:3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 建筑工地上的扬尘可直接导致PM2.5浓度增大 | |
| B. | 化学在环境监测和环境保护中起重要作用 | |
| C. | 臭氧是一种单质 | |
| D. | 厨房油烟不污染空气 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
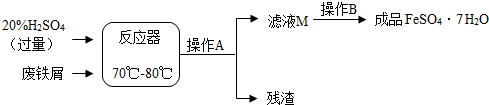
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | ||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com