

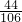 g
g
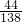 g
g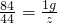
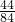 g
g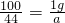
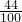 g
g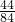 g>
g>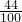 g>
g>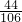 g>
g>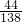 g
g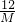 ,根据该计算式可以知道,当碳酸盐的质量相等时,该碳酸盐的相对分子质量越小生成的二氧化碳的质量越大,分析所给四种碳酸盐可以知道:M(Na2CO3)=106,M(K2CO3)=138,M(MgCO3)=84,M(CaCO3)=100,所以可以判断生成二氧化碳气体的质量最大的为碳酸镁.
,根据该计算式可以知道,当碳酸盐的质量相等时,该碳酸盐的相对分子质量越小生成的二氧化碳的质量越大,分析所给四种碳酸盐可以知道:M(Na2CO3)=106,M(K2CO3)=138,M(MgCO3)=84,M(CaCO3)=100,所以可以判断生成二氧化碳气体的质量最大的为碳酸镁.

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:初中化学 来源:化学教研室 题型:013
A.Na2CO3 B.K2CO3
C.MgCO3 D.CaCO3
查看答案和解析>>
科目:初中化学 来源:化学教研室 题型:013
A.Na2CO3 B.K2CO3
C.MgCO3 D.CaCO3
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.Na2CO3 | B.K2CO3 | C.MgCO3 | D.CaCO3 |
查看答案和解析>>
科目:初中化学 来源:2007-2008学年山东省烟台市莱阳市九年级(上)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com