
【题目】根据图示信息回答问题。
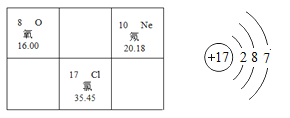
(1)氧的核电荷数为_____。
(2)氖原子的相对原子质量是_____。
(3)氯元素的原子结构示意图如上图所示, 在化学反应中氯原子_____(填“易得”或 “易失”)电子。
(4)氧和氯元素组成的二氧化氯是安全、无毒的消 毒剂,实验室常用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化 氯气体,同时生成硫酸钠和水,反应的方程式为:_____。
(5)如图是甲、乙两种固体(无结晶水)物质的溶解度曲线。
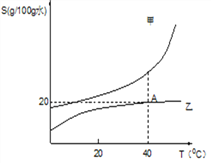
①写出 A 点表示的意义是_____。
②盐碱湖中溶有大量的“NaCl 和 Na2CO3”,当地的人们”冬天捞碱,夏天捞盐”,据此判断图中_________(选填“甲”或“乙”)物质的溶解度与纯碱类似。
③在 40℃时,将 12 g 乙物质加入 50 g 水中充分搅拌,有_____g 固体未溶解。
【答案】 8 20.18 易得 2NaClO3+Na2SO3+H2SO4 ![]() 2ClO2↑+2Na2SO4+H2O 40°时,乙的溶解度为 20g 甲 2g
2ClO2↑+2Na2SO4+H2O 40°时,乙的溶解度为 20g 甲 2g
【解析】(1)原子中,核电荷数=原子序数,故氧的核电荷数为8;(2)氖原子的相对原子质量是20.18;(3)氯元素的原子最外层电子数是7,在化学变化中易得到电子;(4)氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯气体,同时生成硫酸钠和水,反应的方程式为:2NaClO3+Na2SO3+H2SO4![]() 2ClO2↑+2Na2SO4+H2O;(5)①写出A点表示的意义是:在40℃时,乙的溶解度是20g;故答案为:在40℃时,乙的溶解度是20g;②盐碱湖中溶有大量的“NaCl和Na2CO3”,纯碱的溶解度受温度影响较大,所以就用“冬天捞碱,夏天捞盐”的方法得到纯碱,据图可知甲的溶解度受温度的影响比较大,故也用此法;③因为在40℃时,乙的溶解度是20g;即在40℃时,100g水中最多溶解20g乙,所以在40℃时,将12g乙物质加入50g水中充分搅拌,最多溶解10 g乙,故有2g固体未溶解。
2ClO2↑+2Na2SO4+H2O;(5)①写出A点表示的意义是:在40℃时,乙的溶解度是20g;故答案为:在40℃时,乙的溶解度是20g;②盐碱湖中溶有大量的“NaCl和Na2CO3”,纯碱的溶解度受温度影响较大,所以就用“冬天捞碱,夏天捞盐”的方法得到纯碱,据图可知甲的溶解度受温度的影响比较大,故也用此法;③因为在40℃时,乙的溶解度是20g;即在40℃时,100g水中最多溶解20g乙,所以在40℃时,将12g乙物质加入50g水中充分搅拌,最多溶解10 g乙,故有2g固体未溶解。


科目:初中化学 来源: 题型:
【题目】氯化钠(NaCl)和硝酸钾(KNO3)在不同温度时的溶解度及其溶解度曲线如下:
温度(℃) | 10 | 20 | 40 | 60 | 80 | |
溶解度(g) | KNO3 | 20.9 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.8 | 36.0 | 36.6 | 37.3 | 38.4 | |
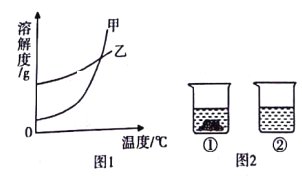
(1)图1中能表示KNO3溶解度曲线的是__________(填“甲"或“乙")。
(2)60℃时,将60gKNO3固体加入到50g水中,充分溶解后,所得溶液是__________(填“饱和”或“不饱和”)溶液,其中溶质与溶剂的质量比为__________(填最简整数比)。
(3)20℃时,向两个分别盛有相同质量的硝酸钾和氯化钠的烧杯中,各加人100g水,充分溶解后,恢复至20℃,其结果如图2所示。下列有关说法中确的是__________(填字母)
A.烧杯①中溶解的是NaC1,烧杯2中溶解的是KNO3
B.升高温度或增加溶剂都有可能将烧杯①中固体全部溶解
C.若将烧杯①中的溶液变为不饱和溶液,溶液的溶质质量分数一定减小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学学习小组的同学在学习了《常见的酸》以后,对蚊虫分泌的让人痛痒不止的蚁酸产生了兴趣。他们在老师指导下对蚁酸进行探究。
(查阅资料)蚁酸的主要成分是甲酸,甲酸的化学式为HCOOH;甲酸溶于水,在一定条件下发生分解反应生成两种氧化物。
(提出问题)甲酸溶液是否具有酸性?
(实验与结论)向盛有甲酸溶液的试管中滴加紫色石蕊溶液,观察到溶液颜色变成红色,说明甲酸溶液显____性。
(提出问题)甲酸分解生成的两种氧化物是什么?
(推断与猜想)
⑴小组同学根据甲酸中含有氢元素,推测出生成物中含有水。
⑵他们对另一种氧化物提出两种猜想:猜想①:二氧化碳;猜想②:一氧化碳。
(实验与结论)
为了证明自己的猜想,他们将甲酸分解产生的气体通过如下图所示的装置(铁架台已略去)。
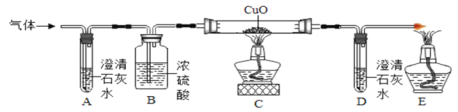
观察到的实验现象如下:
Ⅰ.装置A中澄清石灰水无明显变化。
Ⅱ.装置C中的黑色粉末变红色。
Ⅲ. 装置D中澄清石灰水变浑浊。
(实验结论)甲酸具有酸性,在一定条件下分解生成水和_______。
(拓展延伸)人被蚊虫叮咬后,在其叮咬处涂抹______________可减轻痛痒。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有关物质之间的部分转化关系如图所示。其中“—”表示物质之间能发生化学反应,“→”表示物质之间的转化关系。下列说法中正确的是:
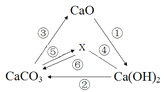
A. 物质X是一种常见的有机化合物
B. 反应②是一定有盐参加反应
C. 图中的所有反应均不属于置换反应
D. 向Ca(OH)2溶液中加入CaO,所得溶液的溶质质量分数一定增大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一瓶保存不当的试剂(如图所示),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小华等几位同学很感兴趣,决定对其成分进行探究.
(提出问题)这瓶试剂溶质是什么?
(1)(交流研讨)根据受损标签的情况判断,这瓶试剂不可能是___(填字母序号)
A.酸B.碱C.盐
(2)(查阅资料)①初中化学常见含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3 . ②Na2CO3、NaHCO3溶液都呈碱性.NaCl溶液呈中性.③室温(20℃)时,4种物质的溶解度的数据如下.
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 36 | 109 | 215 | 9.6 |
(得出结论)小华根据试剂瓶上标注和上表溶解度数据判断,这瓶试剂不可能是______
(3)(猜想与实验)①可能是________溶液; ②可能是NaOH溶液; ③可能是NaCl溶液.
(4)小亮用pH试纸测得该溶液的pH=11,他判断该溶液不可能是________
(5)小强为了确定该溶液的成分,进行了如下实验.
操作步骤 | 实验现象 | 结论及化学方程式 |
步骤一:取样品于试管中,滴加足量________ | 产生大量的气泡 | 猜想①正确. 步骤一发生反应的化学方程式是________ |
步骤二:把产生的气体,通入___ | ________ |
(6)(质疑)小华则不同意小强的观点,认为溶液中有Na2CO3还可能有NaOH.请你帮助他完成以下探究方案
探究步骤 | 预计现象 | 结论 |
步骤一:取样品于试管中,向其中滴加足量的________溶液,充分反应后过滤 | 产生白色沉淀 | 溶液中既含Na2CO3,又含有NaOH |
步骤二:向上述滤液中滴加酚酞试液 | 酚酞试液变___色 |
(7)(反思)为了防止标签发生破损,我们在倾倒溶液时应注意________.(写1点)
(8)(含量计算)小明想测定样品中NaOH的质量分数,称取上述10g样品溶液,逐滴加入7.3%稀盐酸至过量,(不考虑先生成碳酸氢钠的影响)测得生成气体质量与所加稀盐酸质量关系如图2所示:请回答下列问题:
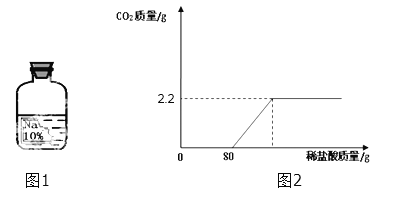
①当稀盐酸加到20g时,样品溶液中的溶质是________
②求样品溶液中NaOH的质量分数_______________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,下列说法错误的是( )
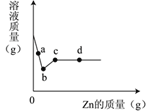
A. a点溶液中的溶质有3种
B. c点溶液中溶质为Zn(NO3)2
C. 取d点时的固体,加入稀盐酸,无气泡
D. 若取b~c段溶液,滴加稀盐酸,不会产生白色沉淀
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为某化学反应的微观过程,其中“![]() ”和“
”和“![]() ”表示两种不同原子.
”表示两种不同原子.
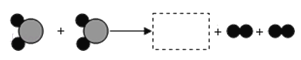
(1)虚线框内应填的微观图示是______(选填A、B、C、D),你推断的依据是___________。
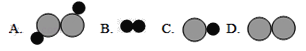
(2)写出符合该微观示意图的一个具体反应的化学方程式:_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钠、钾在元素周期表中的信息如图所示,下列判断不正确的是( )
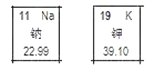
A. 钠原子和钾原子最外层电子数都是 1,所以位于同一族
B. 钠、钾都是金属元素
C. 等质量的金属钠、钾中含有原子个数最多的是钾
D. 钠元素位于元素周期表中的第三周期
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学探究和证据推理是化学学科的核心素养。学习小组对蓝绿色碱式碳酸铜晶体[Cu2(OH)2CO3]的性质进行实验探究,并基于证据进行推理分析。
I.分析碱式碳酸铜的组成
根据化学式可知,碱式碳酸铜中Cu元素的化合价为_____。
Ⅱ.探究碱式碳酸铜受热的变化
(设计实验)学习小组设计了如图装置(夹持仪器已略去),并用于探究碱式碳酸铜的分解产物。
(实验过程)
①在装置丙导管a处连接一导管,并插入水中,微热试管,观察到_____,说明整套装置的气密性良好。
②按图示加入样品和试剂,加热一段时间后,试管中固体变黑,U形管中无水硫酸铜变蓝,澄清石灰水变浑浊。
(实验分析)
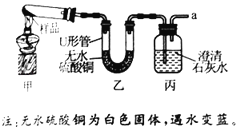
①装置甲中用于加热的仪器名称为_____。
②装置丙中发生反应的化学方程式为_____。
③根据现象可知,碱式碳酸铜受热可分解,分解产物有CO2、CuO、_____。
④装置乙、丙位置不能互换的理由是_____。
Ⅲ.探究碱式碳酸铜与酸的作用
(实验过程)取样品少量于试管中,加水,固体不溶解。继续加入足量稀硫酸,有气泡产生,得到蓝色溶液。
(实验结论)碱式碳酸铜能与硫酸发生反应,生成的盐为_____。
(拓展延伸)碱式盐在生活中应用广泛。碱式氯化铝[Al2(OH)Cl5]是一种高效净水剂。写出碱式氯化铝与盐酸发生反应的化学方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com