
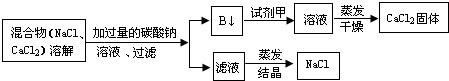


科目:初中化学 来源: 题型:
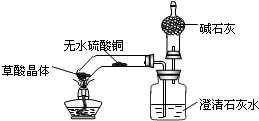 草酸的化学式为H2C2O4,某实验小组对草酸受热分解及其产物进行探究:
草酸的化学式为H2C2O4,某实验小组对草酸受热分解及其产物进行探究:| 实验操作 | 实验现象 | 实验结论 |
| 1.加热草酸晶体 | 无水硫酸铜变蓝色 | 说明有 |
| 澄清石灰水变浑浊 | 说明有 | |
| 2.生成的气体通过碱石灰后,在干燥管的尖嘴处点燃,并在上方罩上内壁附着有澄清石灰水的小烧杯. | 气体燃烧,烧杯内壁的澄清石灰水变浑浊. | 说明有 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验步骤 | 简答 |
1、按图连接好装置; |
1、写出①和②的仪器名称 ① 试管 试管 ② 量筒 量筒 |
| 2、用天平准确称取氢氧化钠样品2g,放人仪器①中,向B中集气瓶内倒入饱和二氧化碳水溶液至瓶颈处 | 2、B中集气瓶盛装的饱和二氧化碳水溶液不能用水代替,其理由是 避免二氧化碳溶解在水里而损耗,造成测定结果偏低 避免二氧化碳溶解在水里而损耗,造成测定结果偏低 |
| 3、向分液漏斗中倒入稀硫酸,打开活塞,让稀硫酸滴人仪器①中至过量,关闭活塞.反应结束后,②中收集到饱和二氧化碳水溶液220mL. | 3、①判断实验步骤3中滴入的稀硫酸已过量的标志是 稀硫酸滴在样品上没有气泡产生 稀硫酸滴在样品上没有气泡产生 ,写出产生气泡的化学反应方程式:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑ Na2CO3+H2SO4═Na2SO4+H2O+CO2↑ |
| 4、经计算样品中碳酸钠的质量分数为53.0%. | 4、集气瓶中收集到二氧化碳的质量是 0.44 0.44 g.(在27℃,101kPa时二氧化碳的密度约为2g/L;二氧化碳的体积等于排出的饱和二氧化碳水溶液的体积). |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
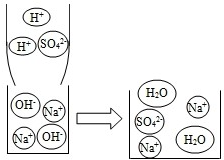 (2012?十堰模拟)实验小组在研究酸和碱的化学性质时,对稀硫酸与NaOH溶液的反应展开探究,请完成他们的探究记录.
(2012?十堰模拟)实验小组在研究酸和碱的化学性质时,对稀硫酸与NaOH溶液的反应展开探究,请完成他们的探究记录.| 实验操作 | 实验现象或数据 | 实验结论 | |
| 方案1 | 取少量NaOH溶液于试管中,测定其pH,将一定量的稀硫酸倾倒入该溶液中,混合均匀后测定其pH | NaOH溶液的pH>7,混合均匀后溶液的pH<7 | 稀硫酸与NaOH溶液混合后发生了化学反应, 且方案1中 稀硫酸 稀硫酸 过量 |
| 方案2 | 取少量NaOH溶液倒入烧杯中,滴入几滴酚酞试液,再用滴管逐滴滴入稀硫酸,并用玻璃棒不断搅拌 | 溶液由红色变为无色 溶液由红色变为无色 | |
| 方案3 | 取少量稀硫酸于试管中,倒入少量硫酸铜溶液,再用滴管逐滴滴入NaOH溶液,边滴边振荡 | 开始无明显现象,滴入一定量NaOH溶液后有蓝色沉淀产生 开始无明显现象,滴入一定量NaOH溶液后有蓝色沉淀产生 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com