
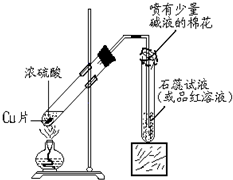
 某化学兴趣小组的同学在探究金属铜的化学性质时,发现铜与稀硫酸在常温或短时间加热的条件下均不反应.那么铜与浓硫酸能否发生反应?他们设计了如图所示装置进行探究.
某化学兴趣小组的同学在探究金属铜的化学性质时,发现铜与稀硫酸在常温或短时间加热的条件下均不反应.那么铜与浓硫酸能否发生反应?他们设计了如图所示装置进行探究.| H2SO4(浓) |
| △ |
| O2 |
| △ |
| H2SO4(稀) |


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:初中化学 来源: 题型:阅读理解
 12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.| 实验操作 | 预期现象 | 结论 |
取样,加入适量的稀盐酸 |
有气泡产生 |
固体产物是Na2CO3,而不是NaOH |
取样,加入适量的稀盐酸 |
没有气泡产生 |
固体是产物NaOH,而不是Na2CO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:


查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
(2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.| 实验操作 | 预期现象及结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com