
 判断生成氢气的多少和消耗酸的多少,而生成的溶液溶质质量分数的大小则需要依据化学方程式进行计算;
判断生成氢气的多少和消耗酸的多少,而生成的溶液溶质质量分数的大小则需要依据化学方程式进行计算; 可知,同质量的镁、铁、锌完全反应生成的氢气大小关系是镁>铁>锌,由于氢气实质上是来源与酸中的氢元素,故生成的氢气越多则消耗的酸越多,故可判断A错误,C正确;
可知,同质量的镁、铁、锌完全反应生成的氢气大小关系是镁>铁>锌,由于氢气实质上是来源与酸中的氢元素,故生成的氢气越多则消耗的酸越多,故可判断A错误,C正确;
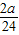 y=
y= z=
z=
 y=
y= z=
z=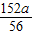 锌反应时x=
锌反应时x= y=
y=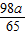 z=
z= ;
; ,比较以上数据可得锌与稀硫酸反应后所得溶液中溶质的质量分数最大;
,比较以上数据可得锌与稀硫酸反应后所得溶液中溶质的质量分数最大;

科目:初中化学 来源:2012-2013学年四川省广安市华蓥一中九年级(下)第一次月考化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目:初中化学 来源:2009年中考化学模拟试卷(13)(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com