
| A. | 铜制孔子像 | B. | 镀锌膜水管 | C. | 大理石墙面 | D. | 铁制栏杆 |
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:填空题
 用元素符号、化学式填空
用元素符号、化学式填空查看答案和解析>>
科目:初中化学 来源: 题型:解答题
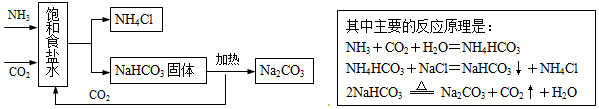
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 二氧化氯消毒液(ClO2)1000 毫升 | |
| 溶质的质量分数 | 80% |
| 密度 相对分 子质量 | 1.2 克/厘米 3 |
| 67.5 | |
| 强腐蚀性,阴冷、密封储藏 | |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 实验步骤 | 现象及结论 |
| 一、分别取少量3种样品于3支试管,加水 | a.一种样品不溶,则是(1)CaCO3. b.二种样品溶解,继续鉴别. |
| 二、取上述步骤b中两种溶液,分别加入 (2)稀盐酸. | c.(3)有气泡产生的是Na2CO3d.没有明显现象的是NaCl. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出2克合金样品,每次加入稀硫酸10克,共加入稀硫酸4次,充分反应后,过滤、洗涤、干燥、称重,得到的实验数据如图所示:
某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出2克合金样品,每次加入稀硫酸10克,共加入稀硫酸4次,充分反应后,过滤、洗涤、干燥、称重,得到的实验数据如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| ①实验操作 | ②实验现象 |
| 剪下一片变黑的铜片,放入试管中, 通入足量的一氧化碳气体 | 铜片表面的黑色物质全部消失,露出红色的铜,将生成的气体通入澄清石灰水,石灰水变浑浊 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com