
| 蜡烛 | 装置Ⅱ | 装置Ⅲ | |
| 反应前的质量/g | 15.8 | 182.3 | 212.2 |
| 反应后的质量/g | 14.4 | 184.1 | 216.6 |

分析 (1)浓硫酸有很强的吸水性;氢氧化钠和氧化钙固体可吸收二氧化碳气体;根据表格中反应后的质量减去反应前的物质质量,即可得出反应后生成的水和二氧化碳的质量;
(2)根据水和二氧化碳的质量可以求出石蜡中碳元素的质量以及氢元素的质量进行解答;
(3)考虑蜡烛的燃烧需要氧气,根据质量守恒定律去解释;
(4)根据空气中也含有水蒸气和二氧化碳进行解答
解答 解:(1)浓硫酸有很强的吸水性.可以吸收蜡烛燃烧后产生的水蒸气;氢氧化钠和氧化钙固体可吸收蜡烛燃烧后生成的二氧化碳气体.所以装置I和II增加的质量分别是水和二氧化碳的质量,反应后生成的水:184.1-182.3=1.8g;反应后生成的二氧化碳:216.6-212.2=4.4g.故答案为:1.8;4.4;
(2)碳元素的质量为:4.4g×$\frac{12}{44}$×100%=1.2g.氢元素的质量为:1.8g×$\frac{2}{18}$×100%=0.2g
蜡烛中碳元素和氢元素的质量比为:1.2g:0.2g=6:1;故填:6:1;
(3)蜡烛的燃烧需要氧气,氧气来自空气中,根据质量守恒定律,参加反应的各物质的质量和等于生成的各物质的质量和,消耗的蜡烛+氧气=水+二氧化碳,装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛减少的质量,是因为有了氧气的参加.故答案为:蜡烛燃烧时,氧气也参与反应,故理论上,装置II和III增加的质量等于消耗的蜡烛和氧气的总质量;
(4)该实验不能准确测出蜡烛燃烧生成二氧化碳和水的质量,原因是空气中水蒸气和二氧化碳也分别被吸收到装置Ⅱ和装置Ⅲ中.故填:不能;空气中水蒸气和二氧化碳也分别被吸收到装置Ⅱ和装置Ⅲ中.
点评 本题以实验探究的形式考查蜡烛燃烧后生成物中碳、氢两种元素的质量比.题目虽不算太难,但仍需同学们细心考虑.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体存在,其化学式为Ca10(PO4)6(OH)2.如图是某牛奶包装盒的部分文字,请你仔细阅读后
人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体存在,其化学式为Ca10(PO4)6(OH)2.如图是某牛奶包装盒的部分文字,请你仔细阅读后查看答案和解析>>
科目:初中化学 来源: 题型:解答题
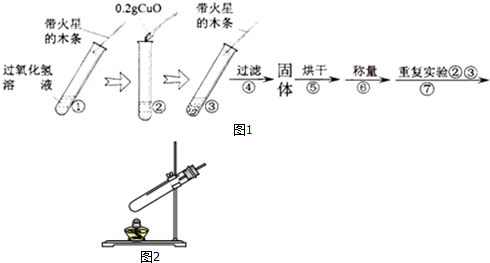
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 剧烈反应,产生大量气泡 带火星的木条复燃 | 0.2g | 溶液中有气泡放出 带火星木条复燃 | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 白色的无水硫酸铜粉末在空气中放置一段时间后变蓝色说明空气中存在水 | |
| B. | 蘸有浓硫酸的玻璃棒在白纸上写字,书写之处纸变黑,证明了浓硫酸有吸水性 | |
| C. | 将人呼出的气体和空气分别通入澄清石灰水,空气不易使石灰水变浑浊,说明空气中有二氧化碳但含量少 | |
| D. | 在碳酸钠溶液滴加酚酞试液,溶液变红,证明了碳酸钠溶液呈碱性 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com