
【题目】小明同学想在实验室完成模拟炼铁的实验,设计下图①→④的思路。已知方框内是初中常见气体制取的发生装置,可供选择的装置见图A或B,提供选择的药品是:氯酸钾晶体、过氧化氢溶液、二氧化锰粉末、稀盐酸、块状石灰石

(1)写出图中标号a、b、c的仪器名称: a是______,b是_______,c是_______;
(2)若用A装置放入①方框内,则X是氧气,写出生成氧气的化学方程式_______;
(3)若用B装置放入①方框内,且能控制反应发生与停止,则X气体______(填能或不能)是氧气,写出生成X气体的化学方程式_____;
(4)③中玻璃管内固体由____色逐渐变成___色,说明氧化铁与一氧化碳反应生成了铁,该化学方程式为______,该反应______(填属于或不属于)置换反应;
(5)④中试管内出现白色浑浊,该化学方程式为_____;④中尾气处理的化学方程式为______。
【答案】铁架台 酒精喷灯 长颈漏斗 2KClO3![]() 2KCl+3O2↑ 不能 CaCO3+2HCl=CaCl2+H2O+CO2↑ 红棕 黑 Fe2O3 +3CO
2KCl+3O2↑ 不能 CaCO3+2HCl=CaCl2+H2O+CO2↑ 红棕 黑 Fe2O3 +3CO![]() 2Fe+3CO2 不属于 Ca(OH)2+CO2=CaCO3↓+H2O 2CO+O2
2Fe+3CO2 不属于 Ca(OH)2+CO2=CaCO3↓+H2O 2CO+O2![]() 2CO2
2CO2
【解析】
氯酸钾和二氧化锰加热生成氯化钾和氧气,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,一氧化碳和氧化铁高温生成铁和二氧化碳,二氧化碳和氢氧化钙生成碳酸钙和水,一氧化碳点燃生成二氧化碳。
(1)图中标号a、b、c的仪器名称: a是铁架台,b是酒精喷灯,c是长颈漏斗。
(2)A装置试管口没有棉花,若用A装置放入①方框内,则X是氧气,生成氧气的反应是氯酸钾和二氧化锰加热生成氯化钾和氧气,反应的化学方程式为2KClO3![]() 2KCl+3O2↑。
2KCl+3O2↑。
(3)B装置含有多孔塑料板,多孔塑料板上面放的是块状固体,若用B装置放入①方框内,且能控制反应发生与停止,则X气体不能是氧气,生成X气体的反应是碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑。
(4)③中反应是一氧化碳和氧化铁高温生成铁和二氧化碳,故玻璃管内固体由红棕色逐渐变成黑色,说明氧化铁与一氧化碳反应生成了铁,该化学方程式为Fe2O3 +3CO![]() 2Fe+3CO2,置换反应是一种单质和一种化合物生成另一种单质和另一种化合物,故该反应不属于置换反应。
2Fe+3CO2,置换反应是一种单质和一种化合物生成另一种单质和另一种化合物,故该反应不属于置换反应。
(5)④中试管内出现白色浑浊,反应是二氧化碳和氢氧化钙生成碳酸钙和水,反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;④中尾气是一氧化碳,一氧化碳点燃生成二氧化碳,故处理的化学方程式为2CO+O2![]() 2CO2。
2CO2。


科目:初中化学 来源: 题型:
【题目】铁及其化合物在生产生活中应用广泛。
(一)铁的性质和应用
(1)某麦片中含微量铁粉,食用后铁粉与胃酸(含HCl)反应转化为人体可吸收的铁元素,反应的化学方程式为_____________________;
(2)人体缺Fe2+影响健康(已知: Fe2+在空气中 易被氧化成Fe3+)。
①琥珀酸亚铁(化学式: FeC4H4O4)是常用补铁剂,其相对分子质量为_____________________;
②硫酸亚铁糖衣片亦能补铁,糖衣除包装药物外,另一作用是_____________________;高铁酸钾是高效杀菌净水剂,反应原理为: ![]() 。 x的化学式为_____________________;
。 x的化学式为_____________________;
(3)铁生锈的次要过程:
![]()
写出Fe转化为FeCO3总反应的化学方程式_____________________;
(4)为防止铁生锈,可对铁制品进行“烤蓝”处理,使其表面生成致密氧化物(其中Fe、O元素质量比为21: 8)保护膜,该氧化物的化学式为_____________________;
(二)废铁的再利用
硫酸铁在农业可用作肥料,是花木,果树制造叶绿素的催化剂。用废铁屑(主要成分为Fe,含少量Fe2O3和FeCO3)制备硫酸铁的主要流程如下:
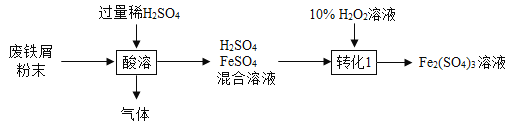
(1)将废铁屑研磨成粉末的目的是_____________________;
(2)“酸溶” 时H2SO4与FeCO3反应生成一种常见气体,反应的化学方程式为_____。
(3)“转化”过程中发生反应的化学方程式为_____________________。反应时温度不宜过高的原因是_____________________;
(三) CH4还原Fe2O3的探究
取40.0gFe2O3粉末,用下图装置进行实验,并对反应及产物等作探究。
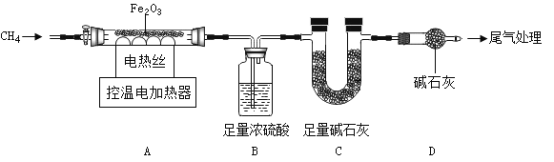
资料:①浓硫酸有吸水性,碱石灰可吸收H2O和CO2.②![]()
(I)装配好实验装置后,先要_____________________;
(2) A中反应:![]() 。下列说法正确的是_____________________;(选填序号)。
。下列说法正确的是_____________________;(选填序号)。
a x:y=1:2
b 装置B、C增加的质量比为9:11
(3)控温加热 一段时间后,继续通CH4至冷却,A中剩余的32.0g 固体为Fe和FeO的混合物。在剩余固体中加一定量稀硫酸溶液,反应刚好完全。
①剩余固体中FeO质量为_____________________g.
②剩余固体和稀硫酸完全反应形成FeSO4的质量为_____________________g.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习了MnO2可催化过氧化氢溶液分解制取氧气后,某同学猜想Al2O3 能否起到类似MnO2的催化作用呢?于是进行了以下探究。
[猜想与假设]
猜想1:Al2O3不是催化剂、也不参与反应,反应前后质量和化学性质不变;
猜想2:Al2O3参与反应并产生O2,反应前后质量和化学性质发生了改变;
猜想3:Al2O3是反应的催化剂,反应前后_____。
[实验设计]用天平称量Al2O3 0.2 g,取5 mL 5%的过氧化氢溶液于试管中,进行如下实验:
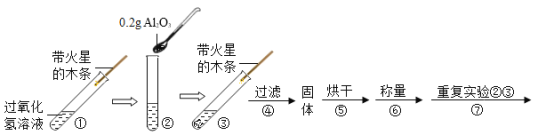
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
溶液中有气泡放出带火星的木条复燃 | 称量Al2O3的质量仍为0.2 g | 溶液中有大量气泡放出_____, | 猜想3成立 |
(2)步骤①③的目的是_____。
(3)写出Al2O3 催化过氧化氢溶液分解产生氧气的文字表达式:_____。
[继续探究]氧化铝是否比二氧化锰的催化效果更好?
小雨以生成等体积的氧气为标准,设计下列三组实验(其他可能影响实验的因素均忽略):
实验序号 | 5%过氧化氢溶液体积 | 催化剂种类及质量 | 待测数据 |
① | 5 mL | ||
② | 5 mL | 0.5 g Al2O3 | |
③ | 5 mL | 0.5gMnO2 |
(4)上述实验测量的“待测数据”是_____。
(5)若测得实验②的数据比实验③的数据大
[实验反思]
(6)影响过氧化氢溶液分解产生氧气快慢的因素还可能有:_____(写两种)。
(7)请设计实验验证你的其中一种猜想:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】欲配制180g溶质质量分数为50%的硝酸铵溶液,实验操作如下图所示,请回答下列问题:

(1)量取所需要的水应选择______(选填“50mL”、“100mL”成“200mL”)量筒。
(2)调平衡后,用托盘天平称量所需的硝酸铵时,发现托盘天平的指针偏向左盘,应______(选填序号)。
A增加适量硝酸铵固体
B减少适量硝酸铵固体
C调节平衡螺母
D增加砝码
(3)将硝酸铵和水依次倒入烧杯中,要用玻璃棒搅拌,其目的是________。
(4)用上述图示的序号表示配制溶液的操作顺序________。
(5)在做⑤操作时,烧杯的温度_______(选填“升高”或“降低”)了。
(6)若量取蒸馏水的体积时仰视读数,则该实验小组实际配制的硝酸铵溶液的溶质质量分数比计划配制的溶质质量分数偏______(填“高”、“低”)。
(7)将制得的硝酸铵溶液装瓶保存时,试剂瓶的标签上应注明______等信息。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是
编号 | ① | ② | ③ | ④ |
水的质量/g | 50 | 50 | 50 | 50 |
加入固体质量/g | 5 | 10 | 15 | 20 |
充分溶解后 | 固体完全溶解 | 固体完全溶解 | 剩余少量固体 | 剩余较多固体 |
A.实验①所得溶液溶质质量分数为10%B.实验说明25℃时该物质的溶解度是20
C.实验③④所得溶液溶质质量分数相同D.实验④所得溶液中含溶质20g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溴在制药、感光材料方面有着独特的作用。下图是溴元素在元素周期表中的截图。据图完成下列各题:

(1)溴元素的原子序数是______;
(2)通常的溴原子的中子数为______;
(3)溴的化学式______;
(4)溴单质在物质分类中属于______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对资料或实验证据的分析是否正确,直接关系到科学探究是否符合客观事实。下图为实验室用等质量的高锰酸钾和氯酸钾(另加少量的二氧化锰),分别制取氧气的数据分析示意图。下列依据图示信息所得出的分析正确的是( )
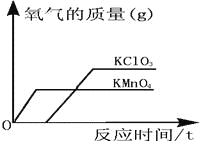
A. 同时开始加热,先收集到氧气的是氯酸钾
B. 用相同容积的试管制取较多量的氧气时,宜选择氯酸钾为原料
C. 加入少量的二氧化锰使氯酸钾产生的氧气质量增加
D. 反应时间较长的是高锰酸钾
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(题文)钠是一种非常活泼的金属,它可以和冷水直接反应生成氢氧化钠和氢气,但是它与煤油不会发生反应。把一小块银白色的金属钠投入盛有蒸馏水的烧杯中(如图a所示)。可以看到钠块浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,甚至会使钠和生成的氢气都发生燃烧。
如果在上述盛蒸馏水的烧杯中先注入一些煤油,再投入金属钠,可以看到金属钠悬浮在煤油和水的界面上(如图b所示),同样与水发生剧烈的反应,但是不发生燃烧。
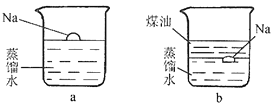
(1)钠和水反应的文字表达式为___________________。
(2)氢氧化钠是一种碱,能让无色酚酞变为红色。如果预先在a烧杯中滴加几滴酚酞试液,实验中可以看到液体颜色变为______色。
(3)在第二个实验中,钠也与水发生反应,但不发生燃烧,猜想这是因为钠和氢气燃烧需要____。
(4)在第一个实验中,钠浮在水面上;在第二个实验中,钠悬浮在煤油和水的界面上。这两个现象说明了____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】注射器是一种普通的医疗器械,但它在化学实验中发挥着越来越大的作用。某化学兴趣小组为了测定空气中氧气的含量,进行了如下探究活动:
(选择药品)小红所在小组认为,选择药品的原则是①既要能消耗氧气,又不会与空气中的其他成分反应;②___________。
(查阅资料)白磷的着火点是40℃,红磷的着火点是240℃,两种物质的燃烧产物五氧化二磷是白色固体,会刺激人体呼吸道,能与空气中的水蒸气反应,生成有毒的偏磷酸(HPO3)。
(设计实验)小明所在小组设计了如图的装置进行探究活动。

(步骤与现象)①测量试管的容积为50mL;②检查装置气密性良好;③装药品,将注射器活塞调整到合适位置,连接好仪器;④用注射器弹簧夹夹紧胶皮管,加热粗铜丝,观察现象;⑤燃烧结束,待试管冷却到室温后打开弹簧夹,观察注射器活塞的移动情况。
(反思与交流)(1)实验中利用了铜丝的__________性。
(2)兴趣小组同学测量试管容积的方法可能是___________。
(3)步骤③中注射器吸水使活塞至少应调到_______(填整数)mL处。
(4)步骤④中观察到试管中的现象有_______;写出白磷燃烧的文字表达式:________。
(5)小华同学认为步骤⑤在保证活塞自由移动的前提下,观察活塞位置时,最好将试管和注射器整体横放,小华同学的理由是_______。
(6)写出该装置测定空气中氧气含量的优点:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com