
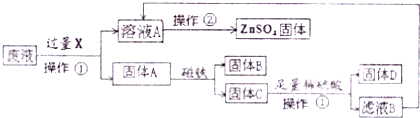


科目:初中化学 来源: 题型:
 某化学兴趣小组的同学发现:发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致.发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究.
某化学兴趣小组的同学发现:发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致.发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究.| 实 验 操 作 | 预期实验现象 | 结 论 |
| 固体产物是Na2CO3,而不是NaOH. |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 化学实验中常常会出现意外情况,这是提升我们学科素养的良好机会,要根据具体情况区别对待,善于发现和解决问题.例如:
化学实验中常常会出现意外情况,这是提升我们学科素养的良好机会,要根据具体情况区别对待,善于发现和解决问题.例如:| 实验目的 | 实验步骤 | 可能的实验现象 | 化学方程式和实验结沦 |
| 探究所用 澄清石灰 水是否变 质 |
①用一支试管另取少 量澄清石灰水 ②取稀硫酸与碳酸钠 反应制取CO2 ③ 将产生的气体通入所用澄清石灰水中 将产生的气体通入所用澄清石灰水中 |
步骤③中现象为: 石灰水变浑浊或未变浑浊 石灰水变浑浊或未变浑浊 |
步骤②中反应方程式为: H2SO4+Na2CO3=Na2SO4+ H2O+CO2↑ H2SO4+Na2CO3=Na2SO4+ H2O+CO2↑ 步骤③可能的反应方程式略 实验结论: 所用澄清石灰水没有变质 或所用澄清石灰水已变质 所用澄清石灰水没有变质 或所用澄清石灰水已变质 |
| 实验目的 | 实验步骤 | 实验现象 | 化学方程式和实验结论 |
| 探究制得的C02中是否含有HCI气体 | 将气体通入硝酸银 溶液 |
硝酸银溶液变浑浊 硝酸银溶液变浑浊 |
反应方程式为: HCl+AgNO3=AgCl↓+HNO3 HCl+AgNO3=AgCl↓+HNO3 实验结论:气体中含有 HCI气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 加入盐 酸的体 积(V) /mL |
2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温 度上升 (△t) /℃ |
5.2 | 9.6 | 12.0 | 16.0 | 18.2 | 16.7 | 15.7 | 14.7 | 13.7 | 12.9 |
| 实验步骤 | 实验现象 | 结 论 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
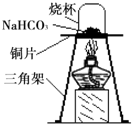
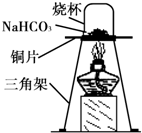 碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.| 实 验 操 作 | 预期实验现象 | 结 论 |
| 取少量固体产物,向其中加入______. | 有气泡产生 | 固体产物是Na2CO3,而不是NaOH. |
查看答案和解析>>
科目:初中化学 来源: 题型:
中和反应在日常生活和工农业生产中有广泛的应用。某化学兴趣小组的同学在老师的指导下对酸碱中和反应进行了探究。
【提出问题】能否用碳酸钾溶液验证硫酸与氢氧化钠溶液发生中和反应?
【实验药品】稀硫酸、稀氢氧化钠溶液、碳酸钾溶液。
【实验仪器】试管、滴管、10mL量筒等
【设计方案并实验】
小江同学的实验:在试管中加入2mL稀硫酸,逐滴加入 溶液,振荡后,再滴入V1mL 溶液,实验过程中无气泡逸出。反应的化学方程式为 。
小伟同学的实验:在试管中加入2mL稀硫酸,逐滴加入氢氧化钠溶液,振荡后,再滴入碳酸钾溶液,有气泡逸出,继续滴加碳酸钾溶液至恰好无气泡时,共消耗碳酸钾溶液V2mL。
小明同学的判断:小江的实验说明能用碳酸钾溶液来验证;小伟的实验还不能,需再做一个实验才能说明。
【实验并判断】另取一支试管,加入2mL稀硫酸,
(写出实验步骤、现象和判断依据)。
【结 论】能用碳酸钾溶液验证硫酸与氢氧化钠溶液发生中和反应。
【反 思】在小江的实验中,碳酸钾溶液的作用是 (填字母)。
A.仅是反应物 B.相当于指示剂 C.作催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com