
| 反应时间/s | 25 | 50 | 75 | 100 | 125 | 150 | 175 | 200 | |
| 滴入稀硫酸体积/mL | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | |
| pH | 13.2 | 13.0 | 12.7 | 12.4 | 12.1 | 7.0 | 2.0 | 1.6 | 1.3 |
| 温度/℃ | 36.9 | 37.5 | 38.0 | 38.5 | 38.8 | 39.2 | 39.0 | 38.8 | 38.6 |
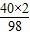 =
=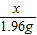


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
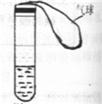 19、某学校课外活动小组利用如图所示的装置做实验:在试管中注入某红色溶液,加热试管一段时间后,溶液红色褪去,冷却后又恢复红色,则原溶液可能是
19、某学校课外活动小组利用如图所示的装置做实验:在试管中注入某红色溶液,加热试管一段时间后,溶液红色褪去,冷却后又恢复红色,则原溶液可能是
查看答案和解析>>
科目:初中化学 来源: 题型:
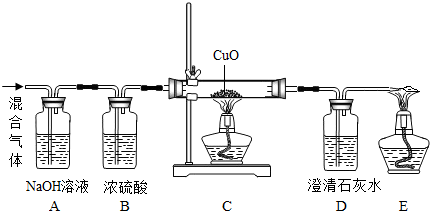
| 实验装置代号 | A | B | D |
| 实验前总质量(g) | 100 | 100 | 100 |
| 实验后总质量(g) | 100.5 | 100.5 | 102.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2005?海门市)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.
(2005?海门市)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 |
| 溶液温度变化(△t)/℃ | 5.2 | 9.6 | 13.0 | 16.0 | 18.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
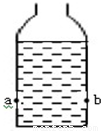
 (2013?苏州模拟)某学校课外活动小组,对某造纸厂废水中NaOH含量进行了测定.取一定量的废水,向其中逐渐滴加溶质质量分数为9.8%的稀硫酸(密度约为l.0g/mL),反应过程中不断搅拌并及时测量不同时刻溶液的温度与pH,记录数据如下表:
(2013?苏州模拟)某学校课外活动小组,对某造纸厂废水中NaOH含量进行了测定.取一定量的废水,向其中逐渐滴加溶质质量分数为9.8%的稀硫酸(密度约为l.0g/mL),反应过程中不断搅拌并及时测量不同时刻溶液的温度与pH,记录数据如下表:| 反应时间/s | 0 | 25 | 50 | 75 | 100 | 125 | 150 | 175 | 200 |
| 滴入稀硫酸体积/mL | 0 | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 |
| pH | 13.2 | 13.0 | 12.7 | 12.4 | 12.1 | 7.0 | 2.0 | 1.6 | 1.3 |
| 温度/℃ | 36.9 | 37.5 | 38.0 | 38.5 | 38.8 | 39.2 | 39.0 | 38.8 | 38.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (1)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为2%的氢氧化钠溶液进行中和,如右图所示.请你计算废水中盐酸的溶质质量分数.(写出具体的计算过程)
(1)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为2%的氢氧化钠溶液进行中和,如右图所示.请你计算废水中盐酸的溶质质量分数.(写出具体的计算过程)| 加入盐酸体积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度t/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com