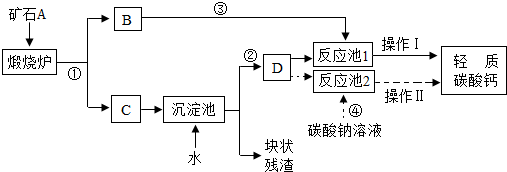
(2012?镇江二模)用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如图所示.
【生产流程】
【相关资料】
a.二氧化碳持续通入氢氧化钙溶液发生如下反应:CO
2+Ca(OH)
2=CaCO
3↓+H
2O,CaCO
3+H
2O+CO
2=Ca(HCO
3)
2;
b.碳酸氢钙微溶于水,微热易分解:Ca(HCO
3)
2═CaCO
3↓+H
2O+CO
2↑;
c.生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆.
【问题讨论】
(1)小王主张用流程①、②、④和操作Ⅱ的设计.请写出反应①和④的化学方程式:①
;④
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
;
操作Ⅱ包括搅拌和
过滤
过滤
、洗涤、烘干等工序;该流程中,通过反应④可回收副产品
NaOH
NaOH
.
(2)小李认为流程①、②、③和操作I比小王的主张更好,理由是:
二氧化碳得到充分利用,节约原料
二氧化碳得到充分利用,节约原料
;
(3)制轻质碳酸钙时,D为
悬浊液
悬浊液
(选填“悬浊液”或“溶液”),理由是:
澄清石灰水中氢氧化钙浓度太小,生产效率很低.
澄清石灰水中氢氧化钙浓度太小,生产效率很低.
.
(4)小李认为得到的产品中可能含有杂质Ca(HCO
3)
2,所以操作Ⅰ包括搅拌、
微热
微热
和过滤、烘干等工序,以提高产率.
【产品含量测定】CaCO
3含量的测定:
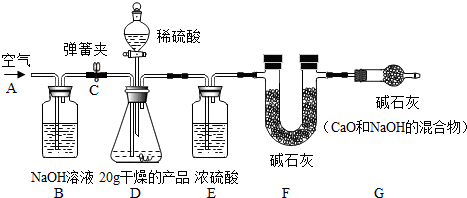
取20.0g产品,研成粉状后,按下图进行实验.
(5)实验步骤:
①连接好装置,检查气密性; ②打开弹簧夹C,在A处缓缓通入一段时间空气;
③称量F的质量; ④关闭弹簧夹C,慢慢滴加稀盐酸至过量,直至D中无气泡冒出;
⑤打开弹簧夹C,再次缓缓通一段时间空气;⑥称量F的质量,得前后两次质量差为8.7g.
(6)问题探究
①产品研成粉的目的
增大接触面积,充分反应
增大接触面积,充分反应
;
②B装置的作用是
除去空气中的二氧化碳
除去空气中的二氧化碳
;G装置的作用是
防止空气中的二氧化碳进入F装置
防止空气中的二氧化碳进入F装置
;
③若没有E装置,则测定的CaCO
3的质量分数会
偏大
偏大
(填“偏大”、“偏小”、“不变”).
称量F的质量,得前后两次质量差为8.7g,可求得产品中CaCO
3的质量分数为
98.86%
98.86%
%.
计算过程:
【总结反思】
某同学设计上述实验方案测定牙膏中钙元素的质量分数:向一定量牙膏中加入过量稀盐酸,测定生成CO
2的质量,据此计算牙膏中钙元素的质量分数.小李同学认为即使排除实验仪器和操作的影响,上述测定的结果仍不一定准确,理由是
二氧化碳能溶于水
二氧化碳能溶于水
.

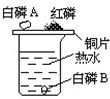 小王用如图所示装置来探究可燃物燃烧的条件.他在烧杯中注入开水(水温为90℃),
小王用如图所示装置来探究可燃物燃烧的条件.他在烧杯中注入开水(水温为90℃),



 (2013?许昌一模)在学习酸和碱的知识时,王老师将几块氢氧化钠放在表面皿中,放置在教室的橱柜里,过了几天,表面皿中块状固体出现了许多白色粉末,同学们就此展开探究.
(2013?许昌一模)在学习酸和碱的知识时,王老师将几块氢氧化钠放在表面皿中,放置在教室的橱柜里,过了几天,表面皿中块状固体出现了许多白色粉末,同学们就此展开探究.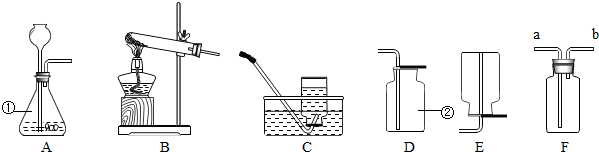
 CaCl2+2NH3↑+2X.X的化学式为: .
CaCl2+2NH3↑+2X.X的化学式为: .