
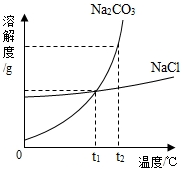
 (1)我国化学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,制得纯碱(Na2CO3),Na2CO3和NaCl的溶解度曲线如图所示:
(1)我国化学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,制得纯碱(Na2CO3),Na2CO3和NaCl的溶解度曲线如图所示:
分析 (1)①根据碳酸钠和氯化钠的溶解度曲线比较;
②根据碳酸钠和氯化钠的溶解度随温度变化的情况分析;
③根据溶质质量分数公式进行解答;
(2)①根据氯化钠和水反应生成氯酸钠和氢气进行解答;
②根据有氯酸钾晶体析出进行解答.
解答 解:(1)①由碳酸钠和氯化钠的溶解度曲线可知,在t1℃时,氯化钠的溶解度等于碳酸钠的溶解度;故填:等于;
②由碳酸钠和氯化钠的溶解度曲线可知,碳酸钠的溶解度受温度的影响较大,氯化钠的溶解度受温度的影响不大若Na2CO3中混有少量的NaCl固体,可用降温结晶方法提纯Na2CO3;故填:降温结晶;
③t1℃时,将15gNa2CO3固体加入到50g水中,所得溶液的溶质质量分数=$\frac{15g}{15g+50g}×100%$=23.1%;故填:23.1%;
(2)①氯化钠和水反应生成氯酸钠和氢气,反应Ⅰ反应方程式为NaCl+3H2O$\frac{\underline{\;通电\;}}{△}$NaClO3+3H2↑;故答案为:NaCl+3H2O$\frac{\underline{\;通电\;}}{△}$NaClO3+3H2↑;
②有氯酸钾晶体析出,所以②Ⅱ中析出晶体后的母液是KClO3的饱和溶液.故填:饱和.
点评 本题考查了学生根据所给的问题情景、图表信息,结合所学溶解度等相关知识和技能,细心地探究、推理,按照题目要求进行认真分析解决问题的能力.


科目:初中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  实验中试管内液面上升,说明试管内压强增大 实验中试管内液面上升,说明试管内压强增大 | |
| B. |  实验中小气球迅速胀大,说明NaOH能与CO2反应 实验中小气球迅速胀大,说明NaOH能与CO2反应 | |
| C. | 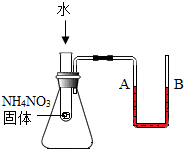 实验中U型管内液面左高右低,说明NH4NO3能与水发生反应 实验中U型管内液面左高右低,说明NH4NO3能与水发生反应 | |
| D. | 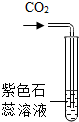 实验中紫色石蕊溶液变红,说明CO2是一种酸 实验中紫色石蕊溶液变红,说明CO2是一种酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
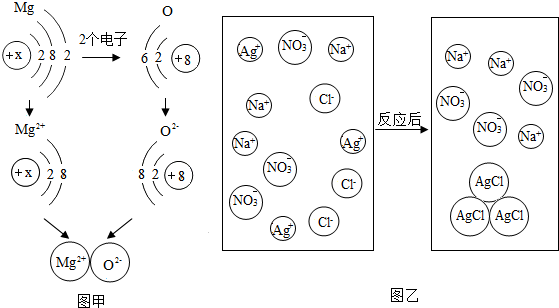
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
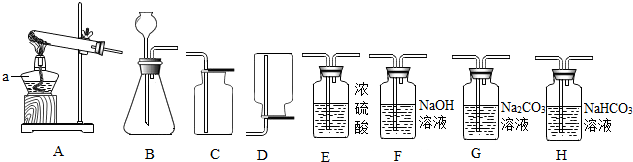
| 步骤和方法 | 现象 | 分析 |
| 取少量反应后的溶液,加入足量的CaCl2溶液 | 产生白色沉淀 | 发生反应的方程式: CaCl2+Na2CO3=CaCO3↓+2NaCl |
| 过滤,向滤液中加入少量NaOH溶液 | 产生白色沉淀 | 结论:猜想③正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 青蒿素属于有机物 | |
| B. | 青蒿素的相对分子质量为282 | |
| C. | 一个青蒿素分子由15个碳原子、12个氢原子和5个水分子构成 | |
| D. | 青蒿素中碳、氢、氧三种元素的质量比为90:11:40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com