
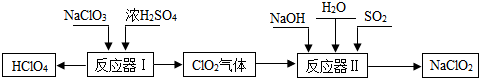
分析 (1)根据在化合物中正负化合价代数和为零,结合HClO4的化学式进行解答即可.
(2)在由两种元素组成的化合物中,其中一种是氧元素的是氧化物,进行分析解答.
(3)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.
解答 解:(1)氢元素显+1价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×4=0,则x=+7价.
(2)ClO2、H2O是由两种元素组成且有一种是氧元素,均属于氧化物.
(3)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式2ClO2+SO2+4NaOH═2NaClO2+X+2H2O,反应前氯、氧、硫、钠、氢原子个数分别为2、10、1、4、4,反应后的生成物中氯、氧、硫、钠、氢原子个数分别为2、6、0、2、4,根据反应前后原子种类、数目不变,则每个X分子由2个钠原子、1个硫原子和4个氧原子构成,则物质X的化学式为Na2SO4.
故答案为:(1)+7;(2)ClO2、H2O;(3)Na2SO4.
点评 本题难度不大,掌握化合价的原则、氧化物的特征、化学反应前后原子守恒是正确解答本题的关键.


科目:初中化学 来源: 题型:选择题
| A. | 硝酸铵溶于水吸收大量的热,食盐溶于水也吸收大量的热 | |
| B. | 氮肥氯化铵与碱研磨可放出氨气,氮肥尿素(CO(NH2)2)与碱研磨也能放出氨气 | |
| C. | 因为燃烧需要同时满足三个条件,所以灭火也要同时控制这三个条件 | |
| D. | 氢气与空气混合点燃可能爆炸,一氧化碳与空气混合点燃也可能爆炸 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
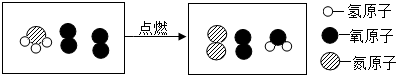
| A. | 该反应前的反应物中氮元素的化合价为-3价 | |
| B. | 该反应前后,分子的种类一定发生变化 | |
| C. | 该反应中参加反应的两种物质的质量比为17:23 | |
| D. | 该反应属于置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 温度(℃) | 0 | 10 | 26 | 30 |
| 水溶液 | 7.31 | 9.28 | 11.03 | 12.98 |
| 氨(8%)溶液 | 1.41 | 1.58 | 2.25 | 3.36 |
| 氨(35%)溶液 | 0.44 | 0.75 | 0.82 | 非常压 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 如图中的A~I表示几种初中化学常贝的纯争物,A、B、C、I是单质,其他均是氧化物;C是紫红色金属,D是磁铁矿石的主要成分,固态的H叫“干冰”.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去.
如图中的A~I表示几种初中化学常贝的纯争物,A、B、C、I是单质,其他均是氧化物;C是紫红色金属,D是磁铁矿石的主要成分,固态的H叫“干冰”.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com