
| A. | C u2+、Mg2+、NO3ˉ、SO42ˉ | B. | Na+、H+、NO3ˉ、SO42ˉ | ||
| C. | K+、Na2+、CO32ˉ、SO42ˉ | D. | K+、Clˉ、Ba2+、NO3ˉ |
分析 根据在pH=1的溶液中则可知溶液中有大量的H+,pH=10的溶液有大量的OH-,然后利用离子之间不能结合生成水、气体、沉淀来分析解答.
解答 解:pH=1的溶液中则可知溶液中有大量的H+,pH=10的溶液有大量的OH-,因此:
A、Cu2+、Mg2+都能和OH-生成沉淀,故不能大量共存,此项错误;
B、H+与OH-反应会生成水,不能大量共存,此项错误;
C、CO32ˉ和H+反应生成二氧化碳气体,不能大量共存,此项错误;
D、Ba2+、K+、Clˉ、NO3ˉ和H+、OH-都不发生反应,能大量共存,此项正确;
故选:D.
点评 本题考查离子的共存问题,学生能利用复分解反应发生的条件来解答即可,还应注意隐含信息的挖掘,如本题PH=1和pH=10的分析和应用.


科目:初中化学 来源: 题型:选择题
| A. | 用活性炭吸附有毒气体 | |
| B. | 金刚石用于裁玻璃 | |
| C. | 用澄清的石灰水来检验二氧化碳气体 | |
| D. | 用同铜来做导线 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
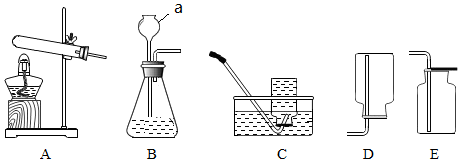
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
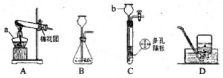 结合图示实验装置,回答下列问题.
结合图示实验装置,回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁丝在氧气中燃烧后质量增大 | |
| B. | 20g食盐溶解到100g水中得到食盐水的质量为120g | |
| C. | 氯酸钾和二氧化锰混合加热后,试管中所剩物质的质量小于原混合物的质量 | |
| D. | 4g氢气和32g氧气恰好完全反应生成36g水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验编号 | 盐酸的浓度(均取20mL) | 温度/℃ | 收集40mL气体所需时间/s |
| ① | 5% | 30 | 48 |
| ② | 10% | 20 | 41 |
| ③ | 5% | 20 | 69 |
| ④ | 10% | 30 | 32 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
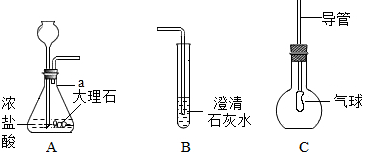 如图为某同学在实验室制取CO2并检验CO2性质的实验装置图.
如图为某同学在实验室制取CO2并检验CO2性质的实验装置图.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 金属 | Cr | A1 | Cu |
| 与盐酸发生反应的现象 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com